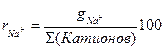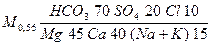Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение физических свойств природной водыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте ВВЕДЕНИЕ Получение студентами глубоких знаний по химическому составу природных вод и методам определения компонентов в зависимости от минерализации воды и присутствия мешающих веществ (ионов, молекул минеральных и органических веществ), а также получения навыков обработки результатов химических анализов воды в виде формул, таблиц и графиков - является основной задачей курса «Химический анализ воды». Цель лабораторных работ - ознакомить студентов специальности 080300 с современными полевыми и лабораторными методами анализа макро - и микрокомпонентного состава природных вод, выработать у студентов навыки квалифицированного выполнения аналитических операций по различным методам химического анализа, научить правильно производить вычисление результатов анализа и квалифицированно делать выводы по химическому составу и физико-химическим свойствам анализируемых вод Методические указания нацелены на самостоятельное выполнение студентами химического анализа во время учебной гидрогеологической и инженерно-геологической практики в четвертом семестре. Дисциплина базируется на знаниях, приобретенных студентами в курсах «Химия», «Вода и цивилизация» и других общегеологических дисциплинах.
ОБЩИЕ ПОЛОЖЕНИЯ Приступая к лабораторным занятиям по химическому анализу воды, студент должен помнить, что малейшая неаккуратность приводит к искажению результатов анализа, на который затрачено много труда и времени. Если при выполнении анализа возникает какая-то ошибка, то его надо переделать. При выполнении отдельных количественных определений следует соблюдать установленную методику работы. В целях экономии времени некоторые операции следует выполнять параллельно. Например, во время определения нитрит ионов (ожидание в течение 20-30 минут появления окраски) можно проводить другие определения.
ТРЕБОВАНИЯ К ОТБОРУ ПРОБ ДЛЯ АНАЛИЗА
Объем пробы воды обычного состава для полного анализа - 1-2 литра. Элементарным правилом при взятии пробы воды должно быть тщательное соблюдение чистоты тары и пробки. Чистую бутылку (стеклянную или пластиковую) нужно несколько раз ополоснуть исследуемой водой. Укупорка для транспортировки должна быть герметичной. Если вода газирует, то следует оставить под водой в бутылке не воздух, а выделяемый водой газ; это предохранит воду от изменений в ее составе. Когда вода не газирует, приходится оставлять в бутылке немного воздуха, так как иначе при изменении температуры пробка может быть выбита. Если воду нужно хранить некоторое время, то ее консервируют прибавкой 1-3 мл хлороформа на 1 литр воды. Перед взятием воды из скважин и колодцев необходимо произвести откачку воды в течение 20-30 минут. При взятии пробы с глубины опускают на шнуре с грузом бутылку, закрытую пробкой, к которой также привязан шнур; на нужной глубине пробку выдергивают. Для взятия проб с больших глубин существуют специальные пробоотборники. Некоторые компоненты воды требуют определения их на месте или специального консервирования, так как при хранении их содержание быстро изменяется. Каждая проба должна быть паспортизирована (приложение 1).
ОПРЕДЕЛЕНИЕ ФИЗИЧЕСКИХ СВОЙСТВ ПРИРОДНОЙ ВОДЫ
Физические свойства воды: температура, запах, прозрачность, легко окисляющиеся в воде вещества и растворенные в воде газы, как правило, - определяются на месте взятия пробы. Температура определяется ртутным или жидкостным термометром в градусах Цельсия С°. Прозрачность (мутность) определяется по стандартной шкале в мг/дм3. Качественное определение производится в пробирке, в которую налито 10 мл исследуемой воды. Глядя сверху, производят наблюдения за степенью прозрачности. Вода бывает: прозрачная, слабоопалесцирующая, опалесцирующая, слегка мутная, мутная, сильно мутная. Количественное определение - по видимости специального шрифта, располагающегося на 4 см ниже пробирки. Выражается в сантиметрах. Взвешенные вещества определяются весовым методом. Осадок (и изменение воды при стоянии): бывает незначительный, заметный, большой; а по качеству - кристаллический, хлопьевидный, илистый или песчаный. По цвету осадок бывает: серый, бурый, черный. Цветность воды: бесцветная, голубоватая, зеленоватая, желтая, бурая - определяется в градусах. Имеются специальные шкалы, градуированные от 0 до 100°. Запах воды определяется нагреванием до 50-60 °С и оценивается в баллах, по пятибальной системе (нет запаха, очень слабый, заметный, отчетливый, очень сильный). Запах бывает: сероводородный, болотный, гнилостный, плесневый. Вкус воды (соленый, горький, вяжущий, сладкий, кислый, пресный) оценивается в баллах. Для питьевых вод ПДК не более 2.0 баллов. Плотность воды определяется ареометром. Точное определение производится весовым путем, с помощью пикнометра. Плотность воды может изменяться от 1 до 1.45 г/см3, для морской воды -1.025 г/см3.
Лабораторная работа № 1 ВИЗУАЛЬНАЯ КОЛОРИМЕТРИЯ Цель работы Определение микрокомпонентов (NH4+, NO2-, Fe3+) и концентрации водородных ионов (рН) в природных водах. Общие сведения В визуальных колориметрических методах интенсивность потока излучения оценивается на глаз. Ряд визуальных методов применяется на практике для определения микрокомпонентов (NH4+, NO2-, Fe3+) и концентрации водородных ионов (рН) в природных водах. Используемые в визуальных методах для сравнения интенсивности окраски калиброванные пробирки должны быть одинакового диаметра, высоты и с одинаковой прозрачностью стекла. Для сравнения окраски используют прибор, называемый компаратором. Прибор состоит из деревянного куба, в котором сверху просверлены два круглых вертикальных отверстия для пробирок и с боков - горизонтальные сквозные отверстия, пересекающиеся с первыми, через которые и сравнивают окраски исследуемого раствора без индикатора и с индикатором. Окраски сравнивают по горизонтальному направлению, подложив белый фон и держа пробирки в наклонном положению к фону, используя пленочные шкалы. ОПРЕДЕЛЕНИЕ рН ПРИ ПОМОЩИ РАСТВОРА УНИВЕРСАЛЬНОГО ИНДИКАТОРА Цель работы Определение кислой, нейтральной или щелочной среды природной воды через концентрацию водородных ионов с использованием универсального индикатора Алямовского и стандартных окрашенных пленочных шкал. Общие сведения Водные растворы всегда содержат водородные и гидроксиль-ные ионы. Произведение концентрации водородных и гидроксиль-ных ионов в воде всегда постоянно и зависит только от температуры. Под концентрацией водородных и гидроксильных ионов понимают содержание грамм-эквивалентов соответствующего иона в одном литре раствора. Если реакция водного раствора нейтральна, концентрация водородных и гидроксильных ионов одинакова и равна Обычно кислую, щелочную или нейтральную среду определяют через концентрацию водородных ионов. Для характеристики концентрации водородных ионов пользуются только показателем степени при десяти, отбрасывая отрицательный знак и обозначая символом рН (показатель концентрации водородных ионов). Колориметрический метод определения рН основан на свойстве ряда индикаторов менять свою окраску в зависимости от концентрации ионов водорода, причем для каждого индикатора существуют вполне определенные границы, при которых происходит изменение окраски. В полевых условиях используют универсальный индикатор Алямовского и стандартные окрашенные пленочные шкалы (диапазон измерений рН 4-8.0). Чувствительность этого метода 0.1 рН. Цель работы Определение содержания иона-аммония в природных водах методом прямого колориметрирования с использованием реактива Несслера. Общие сведения При действии реактива Несслера K2{HgI4}Ha растворы, содержащие ион аммония, происходит образование иодида димеркурам-мония состава Hg2NH2IO, окрашивающего их в желтый цвет. При больших содержаниях аммония выпадает желто-бурый осадок. Колориметрический метод дает возможность определять ион аммония при его содержании от 0.05 мг до 5.0 мг/л. Цель работы Количественное определение содержания нитрит иона в воде с помощью реактива Грисса и стандартных окрашенных пленочных шкал. Общие сведения Метод основан на том, что нитриты в кислой среде взаимодействуют с реактивом Грисса, состоящим из уксуснокислого раствора сульфаниловой кислоты и альфанафтиламина, с образованием окрашенного соединения от слабо-розового до сиренево-красного цвета. Интенсивность появившейся окраски пропорциональна концентрации нитритов в воде. Цель работы Определение иона окисного железа (Fe3+) методом визуальной колориметрии с применением роданида аммония или калия и стандартных окрашенных пленочных шкал на трехвалентное железо. Общие сведения Железо в природных водах содержится в форме ионов Fe3+, Fe2+ , в виде органических соединений и в коллоидном состоянии. Окис-ное железо в больших количествах содержится только в кислых купоросных водах. При взаимодействии роданистого калия или аммония с раствором соли окисного железа образуется родановое железо, окрашивающее раствор в цвета от слабо желтовато-красного до ярко-красного, в зависимости от содержания железа. Реакция протекает только в кислой среде: FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4CI Двухвалентное железо с роданид-ионом не реагирует. Цель работы Определение суммарного содержания железа в воде производится методом визуальной колориметрии после окисления закисного железа до Fe3+. Содержание двухвалентного железа определяют по разности. Общие сведения Ионы Fe2+ в природных водах неустойчивы, вследствие быстроты окисления и выпадения из раствора Fe(OH)3. Для того, чтобы определить сумму Fe2+ и Ре3+надо закисное железо, если оно содержится в воде, перевести в окисное персульфатом калия или аммония и далее определяют сумму железа колориметрическим методом с роданидом аммония. Общие сведения Общее содержание железа определяется после разрушения органического вещества и окисления всех форм железа до Fe3+ роданидным методом. Для определения общего содержания железа в водах, окрашенных органическими веществами, необходимо их разрушить. На практике для этих целей пользуются сегнетовой солью (калий-натрий виннокислый) или выпариванием и прокаливанием сухого остатка. Количество железа, связанное с органическим веществом + коллоидное железо находят по разности между общим содержанием железа и суммой Fe3+ и Fe2+. Аппаратура, приборы* реактивы и растворы Компаратор с плоскодонными пробирками. Кристаллический KHSO4. Кристаллический персульфат калия. 10%-ный раствор KSCN. 2% раствора H2SO4 35% раствора NH4 NO3 Стандартная шкала на Fe3+. Ход определения 10-25 мл воды переносят в фарфоровую чашку, прибавляют 5 мл 2% раствора H2SO4 и 1 мл 35% раствора NH4NO3. Раствор выпаривают досуха и прокаливают сухой остаток до побеления. К прокаленному остатку прибавляют для его растворения 2-5 мл НСl (1:1) и 8-20 мл дистиллированной воды. Далее поступают также, как и при определении Fe3+.
ОБЪЕМНЫЕ МЕТОДЫ АНАЛИЗА В объемном (титриметрическом) методе анализа количественное определение какого-то составляющего компонента воды осуществляется путем точного измерения объемов двух растворов, в которых содержится эквивалентное количество взаимодействующих веществ. При титровании устанавливается момент окончания реакции, т.е. момент, когда в добавленном объеме стандартного (титрованного) раствора содержится количество вещества, эквивалентное количеству определяемого вещества. Этот момент называют точкой эквивалентности. Для объемного анализа можно применять только те реакции, которые протекают с достаточной скоростью. Точно фиксировать точку эквивалентности при медленно идущих реакциях трудно и почти невозможно; раствор обязательно будет перетитрован. При титровании не должны протекать побочные реакции, делающие невозможным точное вычисление результатов анализа. В зависимости от типа реакции, которая протекает во время титрования, различают несколько методов объемного анализа: нейтрализация, осаждение и комплексообразование, окислительно-восстановительные (редоксимертия), прямое титрование, замещение, обратное титрование. Каким бы из методов не проводилось определение, всегда предполагается: • точное измерение объемов одного или обоих реагирующих растворов; • наличие титрованного раствора, при помощи которого проводят титрование; • наличие индикатора, фиксирующего точку эквивалентности: • вычисление результатов анализа. В объемном методе анализа применяют несколько методов вычисления: по нормальности стандартного раствора и по титру стандартного раствора, выраженному в граммах определяемого вещества. Надо помнить, что: • растворы одинаковой нормальности вступают в реакцию в одинаковых объемах; • если нормальности реагирующих растворов различны, то при титровании расходуются различные объемы таких растворов; • растворы разной нормальности реагируют между собой в объемных количествах, обратно пропорциональных их нормальностям. Зная нормальность одного из реагирующих растворов и объемы взаимодействующих растворов, легко определить неизвестную нормальность второго раствора.
Лабораторная работа № 2 Цель работы Определение общей щелочности воды, вызванной гидрокарбонат- и карбонат-ионами. Общие сведения Карбонатная жесткость (общая щелочность) природной воды вызвана присутствием в ней анионов слабых кислот: НСО3-, СОз2-, HS-, HSiO3-, S1O32- и анионами органических кислот, гидролизую-щихся с образованием гидроксил-ионов. В большинстве природных вод щелочность вызывается присутствием гидрокарбонатов и карбонатов щелочных и щелочноземельных металлов, а в сернистых водах еще и гидросернистыми соединениями. Определение производят методом нейтрализации. Метод заключается в том, что бикарбонаты (двууглекислые соли) разлагаются при добавлении в воду соляной кислоты, в результате чего соли, образующие щелочность воды, нейтрализуются Са(НСО3)2 + 2 НС1 = Са С12+ 2Н2О + 2СО2 Mg(HCO3)2 + 2НС1= MgCl2 + 2Н2О + 2СО2 Момент нейтрализации узнают по изменению окраски воды при добавлении индикатора. Если вода содержит ион СОз2-, то от прибавления фенолфталеина она окрашивается в розовый цвет (рН =8.3). Когда вода от фенолфталеина не окрашивается, а от метилового оранжевого приобретает желтую окраску, то в ней содержится только ион НСО3-. Лабораторная работа № 3 ЖЕСТКОСТИ Цель работы Определение общей жесткости воды, вызванной солями кальция и магния, с применением трилона Б и хромогена черного (смеси ЕТ-00 с NaCl) в качестве индикатора. Общие сведения Общая жесткость в природных водах вызывается солями кальция и магния. Различают карбонатную (устранимую) и постоянную жесткость. Карбонатная жесткость обусловлена присутствием в воде бикарбонатов кальция и магния. Если воду прокипятить, то содержащиеся в ней бикарбонаты разлагаются с образованием осадка средних солей и жесткость устраняется, поэтому ее называют устранимой. Постоянная жесткость обусловлена присутствием в воде других растворимых солей кальция и магния (обычно сульфатных), она не может быть устранена кипячением. Сумма постоянной и карбонатной жесткости дает общую жесткость воды. Жесткость в природных водах чаще всего определяется объемным комплексонометрическим методом. Комплексообразование основано на том, что вещество, содержащееся в стандартном растворе, образует с анализируемым катионом прочное комплексное соединение, растворимое в воде. Связывание определяемого иона в комплекс тем полнее, чем прочнее этот комплекс, т.е. чем меньше константа его нестойкости. Наиболее широко применяется комплексон, называемый трилоном Б - это кислая двунатриевая соль этилендиииаминтетрауксусной кислоты (Na2H2Tr). Процесс образования комплекса можно представить уравнением реакции: Са2+ + Na2H2Tr = Na2 (CaTr) + 2Н+ Если в раствор, содержащий ионы кальция и магния, ввести индикатор, дающий цветные соединения с этими ионами, то при добавлении трилона Б к такому окрашенному раствору произойдет изменение окраски в эвивалентной точке. Трилон Б свяжет ионы кальция и магния в прочный комплекс. В качестве индикаторов применяются: для общей жесткости - хромоген черный (ЕТ-00), а для кальция -мурексид. Определению жесткости рассматриваемым методом мешает присутствие двухвалентных меди, цинка и марганца. При наличии в воде марганца, к пробе воды, до введения реактивов, прибавляют 5 капель 1 % раствора солянокислого гидроксиламина. Медь и цинк удаляют прибавлением к раствору 1 мл 2 % раствора сульфида натрия, после чего, не отделяя осадка сульфидов, титруют раствор трилоном Б как обычно. Цель работы Определение в природных водах содержания кальций-иона трилонометрическим методом. Общие сведения Комплексонометрически можно определять не только общее количество ионов кальция и магния в воде, но и количество каждого из этих элементов. Для этого вначале титруют одну аликвоту воды, как было описано выше, а в другой аликвоте оттитровывают только Са2+, применяя в качестве индикатора мурексид (аммонийную соль пурпуровой кислоты). Мурексид при рН больше 9 окрашивает раствор в сине-фиолетовый цвет, а при рН меньше 9 - в красно-фиолетовый. Цвет комплексов мурексида с металлами - красный или желтый, поэтому с мурексидом титруют в щелочной среде. Зная объем раствора трилона Б, израсходованный на титрование кальция и магния с ЕТ-00, и объем раствора, пошедший на титрование кальция, находят объем раствора трилона Б, который расходуется на титрование магния. Бюретка. Ход определения В коническую колбу на 250 мл при помощи пипетки или колбы Мора переносят аликвоту исследуемой воды (50-100 мл). К раствору прибавляют 2,5 мл 2 н раствора гидроксида натрия и 0,03 - 0,05 г сухой смеси индикатора (мурексид + хлорид натрия). При энергичном перемешивании медленно титруют до перехода окраски раствора из красной в лиловую, устойчивую в течение 3 минут. Расчет содержания ионов кальция ведут по формуле:
где V - объем раствора трилона Б, израсходованный на титрование, мл; N - нормальность раствора трилона Б, мг-экв/л; Va - аликвота исследуемой воды в мл; 1000 - пересчетный коэффициент; 20.04 - эквивалентная масса кальция.
Лабораторная работа № 4 Цель работы Определение хлорид-ионов аргентометическим методом (методом Мора). Общие сведения Метод осаждения основан на применении при титровании реакций, в результате которых получаются малорастворимые осадки. Для использования их в титриметрическом анализе необходимо соблюдение ряда условий: результаты титрования не должны искажаться явлением адсорбции, выпадение осадка должно происходить достаточно быстро, осадок должен быть практически нерастворим, должна иметься возможность фиксировать точку эквивалентности. Одним из методов осаждения является аргентометрия (метод Мора). Определение основано на титровании хлорид-ионов раствором Ag NO3 в присутствии индикатора К2СгО4. Первая капля избыточного раствора серебра образует с К2СгО4 осадок хромовокислого серебра, окрашивающего раствор в бурый цвет: Ag+ + Cr-=AgCl СrO4 2- + 2Ag+= Ag2CrO4 Методом Мора титруют только в нейтральной среде, им можно определять содержание хлоридов и бромидов и соли серебра. Он не пригоден для кислых и сероводородных вод. Азотнокислым серебром оттитровывают суммарное содержание ионов хлора, брома и йода. При обычно малом содержании брома и йода, характерном для пресных подземных вод, их присутствие на точности определения хлора не сказывается. Цель работы Определение хлорид-ионов в полевых условиях методом Мора с применением обычной капельницы со стандартным раствором азотнокислого серебра и 10%-ного раствора хромата калия в качестве индикатора. Цель работы Полевое определение сульфат-ионов (SO42-)турбидиметриче-ским методом по П.Н. Бутырину. Общие сведения Определение сульфат ионов производится несколькими методами в зависимости от его содержания и требуемой точности. При содержании сульфат-иона до 20 мг/л применяется турбидиметрический метод. Если содержание сульфат иона - 20-75 мг/л, то применяют турбидиметрический метод по П.Н. Бутырину, а при более 75 мг/л в полевых условиях - объемный, в стационарных - весовой.
ТУРБИДИМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ SO42- ПО П.Н. БУТЫРИНУ Цель работы Определение содержания сульфат-иона в полевых условиях турбидиметрическим методом. Общие сведения Определение производится в мутномерной пробирке, на дне которой есть крест и четыре точки, а на боковой стенке - линейная шкала в мм. К раствору в мутномерной пробирке прибавляют реагенты, которые дают с сульфат-ионом нерастворимый осадок, образующий гомогенную муть. Мутный раствор отбирается из пробирки пипеткой до тех пор, пока, при рассмотрении сверху в полевом мут-номере, не станут видны крест и точки на дне пробирки. Лабораторная работа № 5 БЕЗБЮРЕТОЧНОЕ ТИТРОВАНИЕ Метод разработан и запатентован В.Н. Шемякиным для определения общей жесткости и кальция во время маршрута при проведении гидрогеохимической съемки с использованием специального приспособления - титриметра. ИСПОЛЬЗОВАНИЕМ ТИТРИМЕТРА Цель работы Определение общей жесткости воды при гидрогеохимической съемке с использованием минимального количества реактивов и посуды во время геолого-поисковых и разведочных работ. Общие сведения Определение общей жесткости производится методом обратного титрования. Он основан на том, что вначале в небольшой объем исследуемой воды, налитой в титриметр, вводится ампула с точно известным количеством титрованного раствора трилона Б, индикатор ЕТ-00, хлорид аммония и кристаллический гидрооксид натрия (до появления запаха аммиака). Затем добавляют исследуемую воду до тех пор, пока окраска раствора не изменится из синей в фиолетовую, т. е. наступит момент эквивалентности. Цель работы Определение ионов кальция в жесткой воде при гидрогеохимической съемке с использованием минимального количества реактивов и посуды. Общие сведения Определение содержания кальция также производится методом обратного титрования. ФОТОКОЛОРИМЕТРИЧЕСКИЙ МЕТОД Фотоэлектроколориметрический метод анализа основан на измерении оптической плотности при помощи фотоэлементов. Интенсивность окрашивания, т.е. оптическую плотность анализируемого вещества, сравнивают с оптической плотностью стандартного раствора. Из сложного спектра излучения для каждого элемента выделяют только узкую область. Это достигается при помощи монохроматических светофильтров. Светофильтры пропускают из сложного излучения лишь ту часть света, которая поглощается окрашенным раствором. Светофильтр подбирается по следующей схеме:
При выполнении фотоколориметрического анализа необходимо следовать установленной методике. Конечные объемы всех эталонных и испытуемых растворов должны быть строго одинаковыми, так как только в этих условиях возможно проводить сравнение их окрасок. Кюветы должны быть чистыми и прозрачными. Перед измерением оптической плотности кювету следует ополоснуть небольшой порцией раствора, плотность которого собираются измерить, и заполняют до такого уровня, чтобы поток излучения проходил только через слой раствора. Толщину слоя кюветы выбирают таким образом, чтобы измеряемые величины плотности укладывались в оптический интервал 0.1 - 1.0. Кюветы устанавливают в кюветное отделение прибора всегда в строго определенном положении, на одинаковом расстоянии от источника излучения. Отсчет по шкале прибора следует сделать несколько раз, повторяя весь порядок компенсации, до получения воспроизводимых результатов. Точность отсчета - 0.001 единицы плотности Д.
Лабораторная работа № 6 Цель работы Ознакомление с работой фотоэлектроколориметра КФК-2МП и определение общего содержания ионов железа в воде различного назначения (питьевая, лечебная, хозяйственного назначения). Общие сведения Для выполнения этой работы необходимо ознакомиться с работой фотоэлектроколориметра КФК-2МП, приготовить и определить оптические плотности стандартных растворов железа, построить калибровочную кривую. По описанной ниже методике подготовить испытуемый раствор воды, определить его оптическую плотность и вычислить содержание массовой концентрации железа. Работа на КФК-2МП Выдержать колориметр во включенном состоянии в течение 15 минут при открытой крышке кюветного отделения. Нажать клавишу ПУСК — на цифровом табло появляется мигающая запятая и горит индикатор «Р». В кюветное отделение установить кюветы с растворителем и с исследуемым раствором. Выбрать необходимый светофильтр и нужный фотоприемник. В световой пучок ввести кювету с растворителем или контрольным раствором (положение 1). Закрыть крышку кюветного отделения и нажать клавишу «К». На цифровом табло слева от мигающей запятой загорается символ «1». Ручку перемещения кювет установить в положение 2 (в световой пучок вводится кювета с исследуемым раствором). Нажать клавишу «Д» и на цифровом табло справа от мигающей запятой появится значение оптической плотности исследуемого раствора. Все измерения повторить 3-5 раз и определить оптическую плотность как среднее арифметическое из полученных значений. Лабораторная работа №7 Цель работы Определить концентрацию водородных ионов и окислительно-восстановительного потенциала с помощью потенциометра рН-150. Общие сведения Наиболее точным и быстрым методом измерения рН, Eh и многих других ионов, содержащихся в воде, является потенциометриче-ское определение с помощью рН-150. Определение потенциала электрода производят, измеряя электродвижущую силу концентрационной цепи, состоящей из стандартного электрода с постоянным потенциалом и исследуемого электрода с неизвестным потенциалом, зависящим от концентрации водородных ионов в исследуемом растворе. В качестве стандартного электрода применяют вспомогательный хлорсеребряный электрод типа ЭВЛ-1М4. Измерение рН в природных водах производят с помощью стеклянного электрода марки ЭСЛ-15-11. Перед употреблением стеклянный электрод выдерживают в 0.1 н растворе соляной кислоты в течение недели, а затем калибруют с помощью буферных смесей с известным рН. Измерение Eh (окислительно-восстановительного потенциала) производят с помощью платинового электрода марки ЭПЛ-02. Величина окислительно-восстановительного потенциала может быть отрицательная, равная нулю и положительная. Для процесса окисления Eh положительно, для процесса восстановления - отрицательно. Определение рН и Eh в природных водах с помощью рН-150 производится на месте взятия пробы или в первую очередь при поступлении в лабораторию. Особенно чувствительным к изменению внешних условий является окислительно-восстановительный потенциал Eh, для измерения которого часто изготавливают специальные ячейки с вмонтированными в них электродами. В эти ячейки отбирают пробу непосредственно из исследуемого водопункта. Измерение Eh Измерение рН ОБРАБОТКА И ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ АНАЛИЗА Основной формой выражения результатов анализа воды является ионная форма, так как природная вода является более или менее разбавленным раствором солей. Наряду с ионной формой пользуются миллиграмм-эквивалентной формой выражения анализа, как наиболее полно отражающей внутреннюю химическую природу входящих в состав воды веществ и ее важнейшие свойства. Оформление результатов анализа воды на бланке анализа воды При проведении массовых анализов удобно пользоваться следующей таблицей при объемном методе анализа. Таблица 3
1. Результаты должны быть представлены в таблице в мг/дм3, мг-экв/дм3, % мг-экв (приложение 2). Для расчета мг-экв/л должны быть даны с точностью до сотых единиц (n 0,01); мг/л до целых единиц (n). Определение содержания НСО3-
где Vhci- объем раствора НС1 пошедшего на титрование, мл; Nhci -нормальность раствора, г-экв/л; Va - объем аликвоты 1000 - переводной коэффициент; Э - химический эквивалент иона. Определение содержания Сl-:
Определение общей жесткости
Определение содержания Са 2+
Определение содержания Mg 2+
2. Суммировать мг-экв/л анионов, эту же сумму проставить в графе катионов. Вычислить:
3. Просуммировать все анионы в мг/л, но мг/л НСО3- взять только половину, так как минерализацию рассчитывают по сухому остатку. Вычислить минерализацию в г/л. 4. Если содержание НСО3- в мг-экв/л больше или равно общей жесткости, то вся жесткость - карбонатная. Если НСО3- + СО32- < Жо, то карбонатная жесткость равна их содержанию, а некарбонатная жесткость равна Жо - Жкарб. 5. Вычислить содержание анионов и катионов, в %мг-экв/л: Например, Или 6. Написать формулу солевого состава воды и дать название воды. Например, Название воды: гидрокарбонатная кальциево-магниевая.
ПЕРЕЧЕНЬ ЛАБОРАТОРНЫХ РАБОТ 1. Визуальная колориметрия 2. Определение карбонатной жесткости воды 3. Тригонометрический метод определения общей жесткости и кальция в воде 4. Аргентометрическое определение хлорид-ионов и определение сульфат-ионов по П.Н. Бутырину 5. Безбюреточное титрование 6. Фотоколориметрическое определение общего содержания железа с роданидом аммония 7. Потенциометрический метод анализа ЗАКЛЮЧЕНИЕ Данные методические указания для выполнения лабораторных работ по курсу «Химический анализ воды», предназначенные для выработки практических навыков в проведении анализов воды во время учебной гидрогеологической и инженерно-геологической практики, охватывают небольшое количество определяемых компонентов в природной воде. В практической работе гидрогеологам приходится определять много других важных показателей, как, например: окисляемость, агрессивность, сернистые соединения и различные металлы. Химический анализ воды следует дополнять ионо-селективным анализом, определением окисляемости, агрессивности, фотоколориметрическими методами определения металлов в природных водах. БИБЛИОГРАФИЧЕСКИЙ СПИСОК Основная литература 1. Резников А. А., Мулжовская Е.П., Соколов И.Ю. Методы анализа природных вод.-М.: Недра, 1970 2. ГОСТ 2872-84 «Вода питьевая». М. Из-во стандартов, 1982 Дополнительная 3. Алексеев В.Н. Количественный анализ. М. Из-во «Химия», 1972 4. С.А. Шапиро, М.А. Шапиро. Аналитическая химия. М. «Высшая школа», 1979 5. Лурье Ю.Ю., Рыбникова А.И. Химический анализ производственных сточных вод. М., Химия. 1974 6. Шарло Г. Методы аналитической химии. 4.2. - М.: Химия. 1969 7. СанПиН 2.1.4.559-96. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества: Санитарные правила и нормы. - М.: Инф.-изд. центр Госкомсанэпиднадаора России, 1996
Приложение 1 МИНИСТЕРСТВО ПРИРОДНЫХ Дата отбора пробы ………. РЕСУРСОВ РОССИЙСКОЙ Дата поступления в лабораторию……….. ФЕДЕРАЦИИ Дата начала анализа………. Дата окончания анализа……….
Лаборатория АНАЛИЗ ВОДЫ №_____ 1. Экспедиция, партия, отряд №___. 2. № пробы заказчика___ 3. Название водопункта и его №_ 4. Дебит, л/сек__________ 5. Общая глубина скважины, колодца______м 6. Глубина взятия пробы_____м 7. Глубина расположения фильтров_____м 8. Глубина залегания водоносного горизонта___м 9. Краткая характеристика вмещающих пород и их геологический индекс 10. Технические условия изоляции опробованного водоносного горизонта (цемен-таж, обсадные трубы и др.) 11. Условия и методика отбора пробы 12. Наблюдались ли выделения пузырьков газа_ 13. Температура воды на глубине взятия пробы_ 14. Количество воды, присланной на анализ_ 15. Фамилия отбиравшего пробу_________ Примечание:
Содержание
ВВЕДЕНИЕ Получение студентами глубоких знаний по химическому составу природных вод и методам определения компонентов в зависимости от
|
||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 1844; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.96 (0.019 с.) |

 . Для растворов, имеющих кислую реакцию, концентрация водородных ионов будет больше
. Для растворов, имеющих кислую реакцию, концентрация водородных ионов будет больше  , мг-экв/л
, мг-экв/л , мг/л
, мг/л


 , мг-экв/л;
, мг-экв/л; ,мг/л;
,мг/л;  .
. , мг-экв/л;
, мг-экв/л;  , мг/л;
, мг/л; 
 , мг-экв/л
, мг-экв/л , мг-экв/л;
, мг-экв/л;  , мг/л;
, мг/л; 
 , мг-экв/л;
, мг-экв/л;  , мг/л;
, мг/л; 

 , мг/л;
, мг/л; 
 ,
,