
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение карбонатной жесткости водыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы Определение общей щелочности воды, вызванной гидрокарбонат- и карбонат-ионами. Общие сведения Карбонатная жесткость (общая щелочность) природной воды вызвана присутствием в ней анионов слабых кислот: НСО3-, СОз2-, HS-, HSiO3-, S1O32- и анионами органических кислот, гидролизую-щихся с образованием гидроксил-ионов. В большинстве природных вод щелочность вызывается присутствием гидрокарбонатов и карбонатов щелочных и щелочноземельных металлов, а в сернистых водах еще и гидросернистыми соединениями. Определение производят методом нейтрализации. Метод заключается в том, что бикарбонаты (двууглекислые соли) разлагаются при добавлении в воду соляной кислоты, в результате чего соли, образующие щелочность воды, нейтрализуются Са(НСО3)2 + 2 НС1 = Са С12+ 2Н2О + 2СО2 Mg(HCO3)2 + 2НС1= MgCl2 + 2Н2О + 2СО2 Момент нейтрализации узнают по изменению окраски воды при добавлении индикатора. Если вода содержит ион СОз2-, то от прибавления фенолфталеина она окрашивается в розовый цвет (рН =8.3). Когда вода от фенолфталеина не окрашивается, а от метилового оранжевого приобретает желтую окраску, то в ней содержится только ион НСО3-. Аппаратура, приборы, реактивы и растворы Колба коническая. 0,1%-ный раствор фенолфталеина. 0,1 н раствор соляной кислоты. 0,1%-ный раствор метилового оранжевого. Бюретка. Пипетка или мерная колба. Ход определения (вариант 1) В коническую колбу помещают 50-100 мл исследуемой воды, прибавляют 7-8 капель 0,1%-ного раствора фенолфталеина и осторожно при непрерывном перемешивании титруют раствором соляной кислоты до обесцвечивания раствора. Измеряют объем израсходованной кислоты, добавляют 3-4 капли 0,1%-ного раствора метилового оранжевого и продолжают титровать тем же раствором HCI до перехода окраски из желтой в золотисто-розовую (оранжевую). Содержание ионов СОз2- и НСОз- рассчитывают по формуле:
где V1 - объем раствора соляной кислоты, израсходованный на титрование аликвоты с фенолфталеином, мл; V2 — объем раствора соляной кислоты (считая от начала титрования), израсходованный на титрование аликвоты с метиловым оранжевым, мл; Va - аликвота исследуемой воды, мл; N - нормальность раствора соляной кислоты, г-экв/л; 30 - эквивалентная масса СОз2-; 61 - эквивалентная масса НСО3- ; 1000 - пересчетный коэффициент в мг-экв/л.
Ход определения (вариант 2) Отмеривают пипеткой или колбой 50 или 100 мл исследуемой воды (Va) в коническую колбу на 250 мл, прибавляют 4 капли 0.1% раствора метилового оранжевого и титруют воду на белом фоне по каплям 0.1 н раствором соляной кислоты при постоянном перемешивании до перехода окраски жидкости из желтой в слабо-розовую (золотисто-оранжевую), объем (V1). Рассчитывают содержание НСОз- по формуле:
Лабораторная работа № 3 ТРИЛОНОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ Цель работы Определение общей жесткости воды, вызванной солями кальция и магния, с применением трилона Б и хромогена черного (смеси ЕТ-00 с NaCl) в качестве индикатора. Общие сведения Общая жесткость в природных водах вызывается солями кальция и магния. Различают карбонатную (устранимую) и постоянную жесткость. Карбонатная жесткость обусловлена присутствием в воде бикарбонатов кальция и магния. Если воду прокипятить, то содержащиеся в ней бикарбонаты разлагаются с образованием осадка средних солей и жесткость устраняется, поэтому ее называют устранимой. Постоянная жесткость обусловлена присутствием в воде других растворимых солей кальция и магния (обычно сульфатных), она не может быть устранена кипячением. Сумма постоянной и карбонатной жесткости дает общую жесткость воды. Жесткость в природных водах чаще всего определяется объемным комплексонометрическим методом. Комплексообразование основано на том, что вещество, содержащееся в стандартном растворе, образует с анализируемым катионом прочное комплексное соединение, растворимое в воде. Связывание определяемого иона в комплекс тем полнее, чем прочнее этот комплекс, т.е. чем меньше константа его нестойкости. Наиболее широко применяется комплексон, называемый трилоном Б - это кислая двунатриевая соль этилендиииаминтетрауксусной кислоты (Na2H2Tr). Процесс образования комплекса можно представить уравнением реакции: Са2+ + Na2H2Tr = Na2 (CaTr) + 2Н+ Если в раствор, содержащий ионы кальция и магния, ввести индикатор, дающий цветные соединения с этими ионами, то при добавлении трилона Б к такому окрашенному раствору произойдет изменение окраски в эвивалентной точке. Трилон Б свяжет ионы кальция и магния в прочный комплекс. В качестве индикаторов применяются: для общей жесткости - хромоген черный (ЕТ-00), а для кальция -мурексид.
Определению жесткости рассматриваемым методом мешает присутствие двухвалентных меди, цинка и марганца. При наличии в воде марганца, к пробе воды, до введения реактивов, прибавляют 5 капель 1 % раствора солянокислого гидроксиламина. Медь и цинк удаляют прибавлением к раствору 1 мл 2 % раствора сульфида натрия, после чего, не отделяя осадка сульфидов, титруют раствор трилоном Б как обычно.
|
||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 5050; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.4.20 (0.011 с.) |

 , мг/л
, мг/л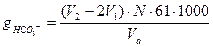 , мг/л
, мг/л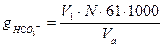 , мг/л
, мг/л


