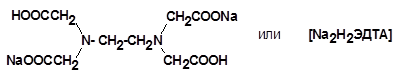Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение бикарбонатной (временной)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ЖЕСТКОСТИ ВОДЫ Определение жесткости воды имеет большое практическое значение и очень широко применяется в технике и промышленности. Жесткость воды возникает в результате растворения в ней солей кальция и магния. В зависимости от состава солей различают временную (бикарбонатную) и постоянную жесткость. Жесткость воды выражается числом миллимолей растворимых солей кальция и магния в 1 литре воды (ммоль/л).
Бикарбонатная (временная) жесткость обусловлена присутствием в воде бикарбонатов кальция и магния: Ca(HCO3)2 и Mg(HCO3)2. Она почти полностью устраняется при кипячении воды, так как растворимые бикарбонаты при этом разлагаются с образованием нерастворимых карбонатов кальция и магния и гидроксокарбонатов магния: Сa(HCO3)2 ® ¯CaCO3 + CO2 + H2O Mg(HCO3)2 ® ¯MgCO3 + CO2 + H2O 2 Mg(HCO3)2 ® ¯(MgOH)2CO3 + 3 CO2 + H2O Постоянная жесткость воды обусловлена присутствием в ней преимущественно сульфатов и хлоридов кальция и магния и при кипячении не устраняется. Сумма величин временной и постоянной жесткости составляет общую жесткость воды: Жобщ.(Н2О) = Жвр. + Жпост. Существуют различные способы определения жесткости воды: определение временной жесткости с помощью метода нейтрализации; комплексонометрический метод определения общей жесткости. Бикарбонатная жесткость воды определяется титрованием воды раствором соляной кислоты в присутствии метилового оранжевого, так как рН в точке эквивалентности находится в области перехода окраски этого индикатора. Сa(HCO3)2 + 2 HCl ® CaCl2 + 2 H2CO3 Mg(HCO3)2 + 2 HCl ® MgCl2 + 2 H2CO3 До начала титрования рН раствора бикарбонатов кальция и магния больше 7 за счет гидролиза солей с участием аниона слабой кислоты. В точке эквивалентности раствор имеет слабокислую реакцию, обусловленную диссоциацией слабой угольной кислоты: Н2СО3 D НСО3- + Н+
Порядок выполнения работы 1. Отберите в коническую колбу пипеткой 100 мл исследуемой водопроводной воды или 10 мл приготовленной жесткой воды и добавьте 2-3 капли метилоранжа. 2. Оттитруйте воду рабочим раствором HCl до оранжевой окраски индикатора. Титрование повторите до получения сходящихся результатов. Результаты титрования запишите в таблицу (см. образец в лаб. раб 1). 3.Вычислите молярную концентрацию эквивалента солей Ca2+ и Mg2+ в воде:
4. Вычислите временную жесткость воды: Жвр.(Н2О) = СЭ(солей) · 1000,(ммоль/л) 5. Вычислите относительную ошибку определения Жвр.
Лабораторная работа № 3 ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ЩЕЛОЧИ И СОДЫ В РАСТВОРЕ ПРИ СОВМЕСТНОМ ИХ ПРИСУТСТВИИ Как известно, щелочи поглощают из воздуха СО2, превращаясь в соответствующие карбонаты: 2 NaOH + CO2 ® Na2CO3 + H2O Поэтому раствор щелочи всегда содержит примеси карбонатов. В некоторых случаях необходимо знать содержание щелочи и карбоната в растворе. В данной лабораторной работе в качестве примера рассмотрим определение содержания NaOH и Na2CO3 при совместном их присутствии. Взаимодействие смеси NaOH и Na2CO3 с сильной кислотой можно рассматривать как три процесса: NaOH + HCl ® NaCl + H2O (I) Na2CO3 + HCl ® NaHCO3 + NaCl (II) NaHCO3 + HCl ® NaCl + CO2 + H2O (III) Определение щелочи и соды при их совместном присутствии проводят с двумя индикаторами: фенолфталеином и метилоранжем. При титровании с фенолфталеином (V1) пройдут процессы I и II, точка эквивалентности будет находится в щелочной среде (из-за процесса гидролиза бикарбоната), т.е. с фенолфталеином оттитровывается вся щелочь и половина соды. Точка эквивалентности процесса III будет находится в кислой среде, поэтому он может быть проведен при титровании с метилоранжем. Эти определения ведут последовательно, не дополняя бюретку кислотой. Точка эквивалентности по метиловому оранжевому показывает конец титрования всей смеси (V2). Количество кислоты, которое вступило в реакцию с ионом НСО3- равно (V2 - V1), следовательно: V (HCl/CO32-) = 2(V2 - V1) Количество кислоты, эквивалентное щелочи, равно: V (HCl/NaOH) = V2 - 2(V2 - V1)
Порядок выполнения работы 1. Получите контрольную смесь NaOH и Na2CO3 в мерной колбе на 100 мл и добавьте дистиллированной воды до метки. Перемешайте раствор. 2. Ополосните и заполните бюретку приготовленной Вами соляной кислотой (не забудьте заполнить конец бюретки). 3. Ополосните пипетку контрольным раствором и отмерьте точный объем исследуемого раствора. Перенесите раствор в колбу для титрования. Добавьте 20-30 мл дистиллированной воды и 5-6 капель фенолфталеина. 4. Оттитруйте смесь соляной кислотой до исчезновения розовой окраски фенолфталеина. Запишите объем кислоты (V1). 5. В колбу для титрования добавьте 2-3 капли метилоранжа. Раствор окрасится в желтый цвет. Продолжите титрование (кислоту в бюретку не доливать) до оранжевой окраски раствора. Запишите объем кислоты (V2). 6. Титрование повторите несколько раз до получения сходящихся результатов. 7. Вычислите молярную концентрацию эквивалентов, титр и массу для соды и щелочи в отдельности по приведенным ранее формулам. 8. Рассчитайте относительную ошибку определения по каждому веществу.
МЕТОД КОМПЛЕКСОНОМЕТРИИ
Комплексонометрия - титриметрический метод анализа, основанный на реакциях комплексообразования определяемых ионов металлов с некоторыми органическими веществами, в частности, с комплексонами. Комплексоны - это аминополикарбоновые кислоты и их производные (соли). Реакции комплексообразования ионов металлов с комплексонами протекают быстро и стехиометрически количественно. В титриметрическом анализе широко используется один из представителей класса комплексонов - динатриевая соль этилендиаминтетрауксусной кислоты (Na2H2ЭДТА). Этот комплексон часто называют также трилоном Б или комплексоном III:
Трилон Б со многими катионами металлов образует прочные растворимые в воде внутрикомплексные соединения (хелаты). При образовании хелата катионы металла замещают два атома водорода в карбоксильных группах трилона Б и образуют координационные связи с участием атомов азота аминогрупп. Образование комплексного соединения можно представить схемой: Me2+ + H2ЭДТА2- ® [MeЭДТА]2- + 2 H+ Точку эквивалентности в процессе комплексонометрического титрования устанавливают с помощью металлохромных индикаторов, которые образуют с титруемыми ионами металлов растворимые окрашенные комплексные соединения, устойчивость которых меньше, чем устойчивость комплексных соединений тех же катионов с трилоном Б. Известно много металлохромных индикаторов. Некоторые из них универсальны, в частности, эриохром черный Т. При рН= 7-11 анион этого индикатора (HInd2-) имеет синюю окраску. С катионами металлов (Ca2+, Mg2+, Zn2+ и др.) в слабощелочном растворе (рН= 8-10) он образует комплексные соединения винно-красного цвета по схеме: Me2+ + HInd2- ↔ MeInd- + H+ синий винно-красный При титровании исследуемого раствора трилоном Б эти комплексные соединения разрушаются, так как ионы металла связываются трилоном Б в более прочный комплекс, а освобождающиеся анионы индикатора переходят в раствор, сообщая ему синюю окраску:
MeInd- + H2ЭДТА2- ↔ [MeЭДТА]2- + HInd2- + H+ винно-красный бесцветный бесцветный синий Кн([CaInd]-) = 3,9.10-6 Кн([CaЭДТА]2-) = 2,7.10-11 Кн([MgInd]-) = 1,0.10-7 Кн([MgЭДТА]2-) = 2,0.10-9 Для более полного протекания реакций комплексообразования (связывания образующихся ионов Н+) к исследуемому раствору при титровании добавляют аммиачный буферный раствор (NH4OH + NH4Cl), рН» 9. Лабораторная работа № 4
|
||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 821; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.20.66 (0.01 с.) |