Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метод калибровочного графикаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для определения концентрации вещества (элемента) в исследуемом растворе используют чаще всего калибровочный (градуировочный) график в координатах А - C (оптическая плотность - концентрация). Готовят серию стандартных растворов с известной концентрацией вещества. Измеряют оптическую плотность этих растворов, сравнивая интенсивности потока излучения, проходящего через стандартный раствор, с интенсивностью потока излучения, проходящего через раствор сравнения, поглощение которого принимают равным нулю. Строят калибровочный график. Калибровочная прямая представляет собой прямую линию, которая идет из начала координат. Затем измеряют оптическую плотность анализируемого раствора и по графику определяют его концентрацию.
Лабораторная работа № 11 ОПРЕДЕЛЕНИЕ МЕДИ (II)
В аммиачных растворах ионы меди образуют комплексные ионы, окрашенные в синий цвет. Cu2+ + 4 NH3 = [Cu(NH3)4]2+ Порядок выполнения работы 1. Возьмите 7 мерных колб на 100 мл для приготовления стандартных растворов соли меди (II). Напишите на них стеклографом номера 0, 1, 2, 3, 4, 5, 6. 2. Налейте из бюретки в колбы, начиная с колбы № 1, точное число мл раствора соли меди (II), который содержит 1 мг меди в 1 мл раствора (см. табл. 3) или другие объемы по усмотрению преподавателя. Таблица 3 Реагенты для фотометрического определения меди (II)
3. В каждую колбу добавьте цилиндром по 5 мл 25 % (концентрированного) раствора аммиака, добавьте дистиллированной воды до метки, закройте пробкой, хорошо перемешайте. 4. Измерьте оптическую плотность каждого стандартного раствора и запишите в таблицу 3. Измерение проводится относительно раствора в колбе № 0 (нулевой раствор) в кюветах с b = 34 мм с использованием желтого светофильтра. 5. По результатам постройте калибровочный график на миллиметровой бумаге в координатах А - C. 6. Получите у преподавателя контрольную задачу с неизвестной концентрацией соли меди (II) (колба № х), добавьте 5 мл 25 % раствора аммиака, доведите дистиллированной водой до метки. Закройте пробкой, хорошо перемешайте. 7. Измерьте оптическую плотность контрольного раствора Аx и по калибровочному графику определите концентрацию меди (II) Сх. Узнайте у преподавателя точной значение концентрации раствора и вычислите погрешность измерения.
ОПРЕДЕЛЕНИЕ ЖЕЛЕЗА (III)
Ионы железа (III) образуют с роданид-ионами комплексные соединения кроваво-красного цвета Fe3+ + (3 - 6) SCN- = [Fe(SCN)3-6] 0 - (-3) Окраска растворов неустойчива, поэтому их готовят непосредственно перед измерением оптической плотности.
Порядок выполнения работы 1. Возьмите 6 мерных колб на 100 мл для приготовления стандартных растворов соли железа (III). Напишите на них стеклографом номера 1, 2, 3, 4, 5, 6. 2. Налейте из бюретки в колбы, начиная с колбы № 1, точное число мл раствора соли железа (III), который содержит 0,02 мг железа в 1 мл раствора (см. табл. 4) или данные преподавателя. 3. В каждую колбу цилиндром добавьте по 2 мл разбавленной (1:1) азотной кислоты и по 10 мл 10%-ного раствора роданида аммония NH4SCN. Добавьте дистиллированной воды до метки, закройте пробкой, хорошо перемешайте.
Таблица 4 Реагенты для фотометрического определения железа (III)
4. Измерьте оптическую плотность каждого стандартного раствора в кюветах с b= 34 мм с использованием синего светофильтра. За “нулевой раствор” возьмите дистиллированную воду. Результаты измерений запишите в таблицу 4. 5. По полученным значениям оптической плотности постройте калибровочный график на миллиметровой бумаге в координатах А - C. 6. Получите у преподавателя контрольную задачу с неизвестной концентрацией соли железа (III) (колба № х), добавьте 2 мл разбавленной (1:1) азотной кислоты, 10 мл раствора роданида аммония, доведите дистиллированной водой до метки. Закройте пробкой, хорошо перемешайте. 7. Измерьте оптическую плотность контрольного раствора Аx и по калибровочному графику определите концентрацию железа (III) Сх. Узнайте у преподавателя точной значение концентрации раствора и вычислите погрешность измерения.
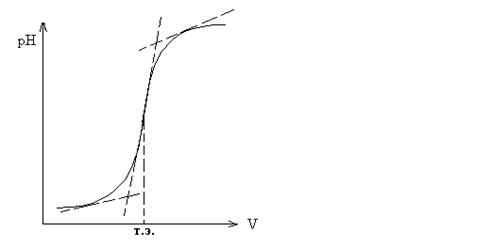
ПОТЕНЦИОМЕТРИЯ Метод потенциометрии основан на зависимости потенциала электрода, погруженного в раствор, от концентрации определенных ионов в данном растворе (уравнение Нернста). Потенциал применяемого в работе стеклянного электрода зависит от концентрации ионов водорода в растворе, что используется при измерении рН. Стеклянный электрод в паре с электродом сравнения, потенциал которого не зависит от рН, опускают в определяемый раствор и измеряют разность их потенциалов. Вольтметр, применяемый для измерений, имеет шкалу, градуированную как в милливольтах, так и в единицах рН, что позволяет снимать показания рН раствора непосредственно со шкалы прибора. При кислотно-основном титровании добавление каждой порции титранта вызывает изменение рН раствора. На этом основано потенциометрическое титрование. К точному объему определяемого раствора последовательно добавляют небольшие порции стандартного раствора и после каждого добавления измеряется рН. Точку эквивалентности определяют графически (см. рис.1 и 2).
Рис. 1. Интегральная кривая: точка эквивалентности соответствует середине отрезка касательной скачка титрования
Рис. 2. Дифференциальная кривая: точка эквивалентности соответствует максимуму кривой. Лабораторная работа № 12
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 3587; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.144.147 (0.006 с.) |