
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дробный и систематический методы анализаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте ЛАБОРАТОРНЫЕ РАБОТЫ ПО КАЧЕСТВЕННОМУ И КОЛИЧЕСТВЕННОМУ АНАЛИЗУ
Для студентов специальностей и направлений: “Лечебное дело”, “Экология и природопользование”, “Экология”, “Природопользование”, “Геология и разведка месторождений полезных ископамых”, “Агрономия”, “Ветеринария”, “Зоотехния”
Москва Издательство Российского университета дружбы народов
Утверждено Редакционно-издательским советом РУДН
Линко Р.В., Колядина Н.М., Гридасова Р.К., Рябов М.А. Лабораторные работы по качественному и количественному анализу для студентов специальностей и направлений “Лечебное дело”, “Экология и природопользование”, “Экология”, “Природопользование”, “Геология и разведка месторождений полезных ископаемых”, “Агрономия”, “Ветеринария”, “Зоотехния”. - М.: Изд-во РУДН, 2005.-104 с.
Лабораторные работы по качественному и количественному анализу подготовлены в соответствии с программами курсов химии специальностей и направлений “Лечебное дело”, “Экология и природопользование”, “Экология”, “Природопользование”, “Геология и разведка месторождений полезных ископаемых”, “Агрономия”, “Ветеринария”, “Зоотехния”.
Подготовлено на кафедре общей химии РУДН.
ã Российский университет дружбы народов, 2005 г.
КАЧЕСТВЕННЫЙ АНАЛИЗ Для определения качественного химического состава вещества пользуются как химическими, так и физико-химическими методами анализа. Химические методы основаны на использовании химических реакций определяемого элемента с различными реагентами. В качественном анализе используются аналитические реакции. Аналитическая реакция - это реакция, которая сопровождается каким-либо внешним эффектом (образованием или растворением осадка, выделением газа, изменением окраски раствора и т.д.), позволяющим сделать вывод о наличии соответствующих ионов или молекул в анализируемом веществе. Аналитические реакции делятся на специфические и групповые. Специфическая реакция – это аналитическая реакция, внешний эффект которой характерен только для данного иона или соединения. С помощью специфической реакции ион может быть обнаружен в присутствии других ионов. Групповая реакция – это реакция, внешний эффект которой характерен для группы ионов. С помощью групповых реакций смеси ионов разделяют на аналитические группы. Большинство аналитических реакций выполняется в водных растворах. Так как подавляющее большинство неорганических соединений в растворах диссоциировано, то при анализе практически определяются не элементы вообще, а ионы. Поэтому качественный анализ делится на анализ (открытие, обнаружение) катионов и анализ анионов.
Дробный и систематический методы анализа Качественный анализ может быть выполнен дробным или систематическим методом. Дробный метод анализа заключается в том, что ионы открывают в любой последовательности при помощиспецифических реакций в отдельных пробах раствора в присутствии других ионов. Однако не всегда дробный метод можно использовать на практике, так как не для всех ионов имеются специфические реакции. Поэтому при анализе смеси ионов в основном пользуются систематическим методом анализа. Систематический метод качественного анализа заключается в том, что смесь ионов с помощью групповых реагентов предварительно разделяют в определенной последовательности на аналитические группы. Отдельные ионы внутри каждой группы обнаруживаются с помощью их аналитических реакций после разделения или в условиях, устраняющих (маскирующих) влияние других ионов.
АНАЛИТИЧЕСКАЯ КИСЛОТНО-ОСНОВНАЯ КЛАССИФИКАЦИЯ КАТИОНОВ В основе кислотно- основной классификации катионов, предложенной С.Д. Бесковым и О.А. Слизковой, лежит их различное отношение к соляной и серной кислотам, к растворам щелочей и аммиака. Катионы делятся на шесть аналитических групп (см. табл. 1). Первая аналитическая группа катионов (растворимая группа) включает ионы К+, Na+ и NH4+. Эта группа не имеет группового реагента, так как большинство соединений катионов этой группы хорошо растворимо в воде. Вторая аналитическая группа катионов (хлоридная группа) включает катионы Ag+, Hg22+, Pb2+. Групповым реагентом является соляная кислота, которая осаждает эти катионы в виде малорастворимых хлоридов. Третья аналитическая группа катионов (сульфатная группа) включает катионы Ba2+, Ca2+, Sr2+. Их групповым реагентом является серная кислота, которая осаждает эти катионы в виде малорастворимых в воде сульфатов. Четвертая аналитическая группа катионов (амфолитная группа) объединяет катионы Аl3+, Cr3+, Sn2+, Zn2+. Групповым реагентом служит раствор щелочи, при действии избытка которого образуются растворимые комплексные соединения (гидроксокомплексы).
Таблица 1 Аналитическая кислотно-основная классификация катионов
Пятая аналитическая группа катионов (гидроксидная группа) включает ионы Mg2+, Fe2+, Fe3+, Mn2+, Sb3+. В качестве группового реагента используется 25%-ный раствор аммиака, который осаждает эти катионы в виде гидроксидов, нерастворимых в избытке реагента. Шестая аналитическая группа катионов (аммиакатная группа) объединяет ионы Сu2+, Co2+, Ni2+. Групповым реагентом является 25%-ный раствор аммиака, при избытке которого образуются растворимые в воде комплексные соединения (аммиакаты). Анализ смеси катионов I-VI аналитических групп, основанный на кислотно-основной классификации, начинают обычно с обнаружения иона аммония дробным методом.
Систематический анализ начинают с осаждения и отделения хлоридов катионов II аналитической группы. Затем переводят в осадок и отделяют сульфаты катионов III аналитической группы. При обработке раствора, полученного после осаждения катионов II и III аналитических групп, избытком раствора гидроксида натрия в осадок переводят основные по своей природе гидроксиды катионов V и VI групп, а в растворе остаются катионы IV аналитической группы в виде соответствующих гидроксокомплексов. При обработке концентрированным раствором аммиака осадка, содержащего катионы V и VI аналитических групп, катионы VI аналитической группы образуют растворимые комплексные соединения - аммиакаты, тогда как катионы V аналитической группы остаются в осадке в виде соответствующих гидроксидов. После разделения катионов на группы с помощью групповых реагентов проводят обнаружение ионов внутри каждой группы.
Лабораторная работа № 1 АНАЛИЗ СМЕСИ КАТИОНОВ I - III АНАЛИТИЧЕСКИХ ГРУПП Предварительные испытания 1. С помощью универсального индикатора определите рН раствора. 2. Проведите реакцию открытия иона NH4+ (см. л.р.1). 1. Осаждение хлоридов катионов II аналитической группы групповым реагентом HCl (2 М) 1.1. Поместите в центрифужную пробирку 2-3 мл исследуемого раствора и прибавьте к нему 8-10 капель 2 М раствора HCl. Перемешайте смесь стеклянной палочкой и затем отделите осадок от раствора центрифугированием. Проверьте полноту осаждения. Для этого к раствору над осадком (центрифугату) прибавьте еще 2-3 капли раствора HCl. Если при этом не происходит помутнение раствора, то осаждение полное. Осадок 1 Центрифугат 1 PbCl2, AgCl, Hg2Cl2 NH4+, Na+, K+, Ba2+, Ca2+ 1.2. Центрифугат 1 слейте с осадка в отдельную пробирку и напишите номер (стеклографом или восковым карандашом). Оставьте этот раствор для дальнейшего анализа. 1.3. Работайте с осадком 1. Осадок промойте дистиллированной водой, содержащей 2-3 капли HCl. Отделите осадок от раствора центрифугированием, осторожно слейте раствор с осадка в раковину. К промытому осадку добавьте 2-3 мл дистиллированной воды, перемешайте стеклянной палочкой и нагрейте на водяной бане. PbCl2 (если он есть) должен раствориться в горячей воде. В осадке останутся (если они есть) AgCl и Hg2Cl2 (осадок 2). 1.4. Отделите осадок 2 от раствора центрифугированием. Центрифугат 2 слейте в отдельную пробирку и проведите реакцию открытия Pb2+ (реакцией с KI). Осадок 2 Центрифугат 2 AgCl, Hg2Cl2 Pb2+ 1.5. К оставшемуся в центрифужной пробирке осадку 2 прибавьте 2-3 мл концентрированного раствора NH3, перемешайте смесь стеклянной палочкой. AgCl (если он есть) растворится в растворе аммиака с образованием бесцветного раствора аммиаката серебра [Ag(NH3)2]Cl (см. л.р. 2). Hg2Cl2 (если он есть) превращается в смесь [HgNH2]Cl и Hg - черного цвета (см. л.р. 2).Отделите осадок 3 от раствора центрифугированием. Осадок 3 Центрифугат 3 [HgNH2]Cl + Hg [Ag(NH3)2]+ + Cl- 1.6. К центрифугату 3 добавьте 1-2 капли фенолфталеина и затем по каплям раствор HNO3 (конц.) до исчезновения малиновой окраски. Комплексный аммиакат серебра [Ag(NH3)2]Cl (если он есть) разрушается с образованием белого осадка AgCl. Примечание. Если при проведении реакций Вы не наблюдаете ожидаемый эффект, следовательно, в Вашей задаче отсутствуют соответствующие катионы.
Осадок 4 Центрифугат 4 BaCrO4 NH4+, Na+, K+, Ca2+, Cr2O72- 2.3. Центрифугат 4 окрашен в оранжевый цвет из-за присутствия ионов Cr2O72-. К этому центрифугату прибавьте 5-7 капель раствора оксалата аммония (NH4)2C2O4. Если в растворе присутствуют ионы Ca2+, выпадает белый осадок, цвет которого хорошо виден после центрифугирования. Осадок 5 промойте дистиллированной водой и проверьте его растворимость в соляной и уксусной кислотах, а центрифугат 5 вылейте в раковину. Осадок 5 Центрифугат 5 СаC2O4 NH4+, Na+, K+, Cr2O72-
Осадок 6 Центрифугат 6 Карбонаты I и III групп Na+, K+ 3.3. К центрифугату 6 прибавьте 1-2 капли фенолфталеина, несколько капель раствора CH3COOH, до исчезновения малиновой окраски и немного свежеприготовленного раствора Na3[Co(NO2)6] (см. л.р. 1). Образование желтого осадка K2Na[Co(NO2)6] свидетельствует о присутствии в растворе ионов калия. 3.4. Для открытия ионов Na+ из исходного раствора с помощью раствора карбоната калия K2CO3 осаждают катионы II и III аналитических групп, а в растворе остаются ионы Na+. В центрифужную пробирку поместите 1-2 мл исходного раствора и прибавьте 1-2 мл раствора K2CO3. Отделите осадок от раствора центрифугированием. Осадок 7 Центрифугат 7 Карбонаты II и III групп Na+, K+ 3.5. К 2-3 каплям центрифугата 7 прибавьте 3-4 капли раствора K[Sb(OH)6] и охладите под струей холодной воды при потирании стеклянной палочкой (см. л.р.1). Образование белого мелкокристаллического осадка Na[Sb(OH)6] свидетельствует о присутствии ионов натрия.
Лабораторная работа № 5 Предварительные испытания. 1. Обратите внимание на окраску раствора. Отсутствие окраски дает возможность предположить, что в растворе нет катионов Cr3+, Fe2+, Fe3+, Mn2+, Cu2+, Co2+, Ni2+. Ионы: Cr3+ окрашивают раствор в фиолетовый цвет Fe2+ - «- в светло-зеленый цвет Fe3+ - «- в желтый цвет Mn2+ - «- в светло-розовый цвет Cu2+ - «- в голубой цвет Co2+ - «- в розовый цвет Ni2+ - «- в зеленый цвет. Примечание: в разбавленных растворах окраска ионов Fe2+ и Mn2+ не наблюдается. На основании цвета раствора сделайте предположение о возможном присутствии ионов. 2. С помощью универсального индикатора определите рН раствора. 3. Дробным методом проведите открытие ионов, обнаружению которых не мешают другие ионы: Fe2+ - реакция с гексацианоферратом (III) калия; Fe3+ - реакция с гексацианоферратом (II) калия и радонидом аммония; Mn2+ - реакция с висмутатом натрия в присутствии азотной кислоты. 4. Осаждение катионов V и VI аналитических групп Поместите в центрифужную пробирку 2 – 3 мл исследуемого раствора и прилейте к нему избыток раствора NaOH (2N). Смесь перемешайте стеклянной палочкой. Осадок 1 отделите от раствора центрифугированием. Центрифугат 1 слейте в отдельную пробирку и напишите на ней номер.
Осадок 1.Центрифугат 1. Fe(OH)2, Fe(OH)3, [Zn(OH)4]2-, Mn(OH)2, Cu(OH)2, [Al(OH)6]3-, Co(OH)2, Ni(OH)2 [Cr(OH)6]3-, 5. Открытие ионов Zn2+, Al3+, Cr3+ Поместите в пробирку 2 – 3 мл центрифугата 1 и прибавьте к нему для нейтрализации 1 – 2 мл раствора HCl (2N). Из полученного раствора в отдельных пробах дробным методом откройте ионы: Zn2+ - реакция с дитизоном; Al3+, - реакция с ализарином; Cr3+ - реакция с пероксидом водорода в избытке щелочи. 6. Растворение осадка 1 и открытие ионов Cu2+, Co2+, Ni2+ К осадку 1 прилейте 2 – 3 мл раствора HNO3 (2N) и нагрейте на водяной бане до полного растворения осадка. В растворе находятся ионы Fe3+, Mn2+, Cu2+, Co2+, Ni2+. Из полученного раствора в отдельных пробах дробным методом откройте ионы: Cu2+ - реакция с избытком раствора аммиака; Co2+ - реакция с роданидом аммония или калия; Ni2+ - реакция с реактивом Чугаева. Результаты анализа в виде уравнений реакций запишите в рабочей тетради и покажите отчет преподавателю.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Количественный анализ изучает методы определения количества составных частей (элементов, ионов, молекул, радикалов, функциональных групп и т.д.) в анализируемом образце (веществе, сложном материале, минерале, горной породе). Методы количественного анализа делятся на химические, физико-химические и физические. Отнесение метода к той или иной группе зависит от того, в какой мере количественное определение основано на использовании химических реакций, физико-химических или физических процессов. Соответственно трем агрегатным состояниям материи - твердому, жидкому и газообразному - количественные измерения проводят путем определения массы (взвешивание) и путем определения объемов жидких и газообразных веществ. К химическим методам относятся гравиметрический (весовой), титриметрический (объемный) и газовый анализ. Физические и физико-химические методы включают оптические, электрохимические, масс-спектральный, хроматографический, радиометрический и др.
Приемы титрования Прямое титрование - это простейший прием титрования, заключающийся в том, что к определенному объему раствора определяемого вещества (А) по каплям приливают титрант (рабочий раствор) вещества (В). Зная концентрацию и объем рабочего раствора (В), израсходованного на реакцию с определяемым веществом (А), можно легко вычислить концентрацию последнего:
Если основная реакция идет медленно, или нет подходящего индикатора для фиксирования точки эквивалентности, особенно при работе с неустойчивыми веществами, то применяют обратное или заместительное титрование. Обратное титрование - это процесс титрования, при котором к определенному объему раствора определяемого вещества (А) приливают точно известный объем титранта (В1), взятого в избытке. Избыток, не вошедшего в реакцию вещества (В1), оттитровывают раствором другого титранта (В2) точно известной концентрации. Расчеты производят по формулам:
nэ(A) = nэ(B1) - nэ(B2);
Титрование заместителя. Сущность этого метода заключается в том, что к определяемому веществу (А) прибавляют вспомогательное вещество (Р), реагирующее с ним с выделением эквивалентного количества нового вещества (А1), которое оттитровывают соответствующим титрантом (В). Другими словами, вместо непосредственного титрования определяемого вещества (А) титруют его заместитель (А1). Так как количества А и А1 эквивалентны, то количество вещества эквивалента определяемого вещества nэ(А) равно количеству вещества эквивалента титранта nэ(В): nэ(A) = nэ(А1) = nэ(B);
Таблица 2 Лабораторная работа № 1 Стандартизация раствора HCl Приготовьте для титрования штатив с бюреткой, коническую колбу, пипетку, маленькую воронку, стакан для слива растворов, индикатор - метилоранж. 1. Чистую бюретку промойте и затем заполните раствором соляной кислоты. Удалите воздух из нижнего конца бюретки. Выньте воронку и доведите уровень жидкости в бюретке до нулевого деления по нижнему краю мениска. 2. В колбу для титрования из общей бюретки отмерьте 10 мл титрованного раствора NaOH. 3. Добавьте цилиндром в колбу со щелочью 20-30 мл дистиллированной воды и 2-3 капли раствора метилоранжа. Раствор окрасится в желтый цвет. 4. Титруйте раствор NaOH раствором соляной кислоты, постепенно приливая раствор из бюретки при постоянном перемешивании. В конце титрования раствор из бюретки добавляйте по каплям. В точке эквивалентности раствор окрасится в оранжевый цвет. При добавлении лишней капли кислоты цвет раствора станет розовым. 5. Запишите в тетрадь объем соляной кислоты, пошедший на титрование щелочи. Титрование повторяйте до тех пор, пока не получите результаты, отличающиеся между собой не более чем на 0,1 мл. Результаты запишите в таблицу. 6. Зная объем щелочи (V(NaOH)), молярную концентрацию эквивалента щелочи (CЭ(NaOH)) и средний объем соляной кислоты (V(HCl)), пошедший на титрование, вычислите молярную концентрацию эквивалента соляной кислоты (СЭ(HCl)) и ее титр (Т(HCl)). Полученный раствор соляной кислоты будет служить титрантом (рабочим раствором) в дальнейших определениях.
_____________________________________________________ ОБРАЗЕЦ оформления лабораторной работы в Титриметрическом анализе Лабораторная работа №... Дата “Название лабораторной работы” Первичный стандарт - СЭ(NaOH) = …………моль/л Определяемое вещество (титрант) - СЭ(HCl) =?, T(HCl) =? Индикатор - метилоранж Условия титрования - (рН среды, нагревание и т.д.) Уравнение реакции (в молекулярной и ионно-молекулярной формах): Результаты эксперимента заносятся в таблицу:
V ср. (HCl) = Вычисления:
Лабораторная работа № 2 ЖЕСТКОСТИ ВОДЫ Определение жесткости воды имеет большое практическое значение и очень широко применяется в технике и промышленности. Жесткость воды возникает в результате растворения в ней солей кальция и магния. В зависимости от состава солей различают временную (бикарбонатную) и постоянную жесткость. Жесткость воды выражается числом миллимолей растворимых солей кальция и магния в 1 литре воды (ммоль/л).
Бикарбонатная (временная) жесткость обусловлена присутствием в воде бикарбонатов кальция и магния: Ca(HCO3)2 и Mg(HCO3)2. Она почти полностью устраняется при кипячении воды, так как растворимые бикарбонаты при этом разлагаются с образованием нерастворимых карбонатов кальция и магния и гидроксокарбонатов магния: Сa(HCO3)2 ® ¯CaCO3 + CO2 + H2O Mg(HCO3)2 ® ¯MgCO3 + CO2 + H2O 2 Mg(HCO3)2 ® ¯(MgOH)2CO3 + 3 CO2 + H2O Постоянная жесткость воды обусловлена присутствием в ней преимущественно сульфатов и хлоридов кальция и магния и при кипячении не устраняется. Сумма величин временной и постоянной жесткости составляет общую жесткость воды: Жобщ.(Н2О) = Жвр. + Жпост. Существуют различные способы определения жесткости воды: определение временной жесткости с помощью метода нейтрализации; комплексонометрический метод определения общей жесткости. Бикарбонатная жесткость воды определяется титрованием воды раствором соляной кислоты в присутствии метилового оранжевого, так как рН в точке эквивалентности находится в области перехода окраски этого индикатора. Сa(HCO3)2 + 2 HCl ® CaCl2 + 2 H2CO3 Mg(HCO3)2 + 2 HCl ® MgCl2 + 2 H2CO3 До начала титрования рН раствора бикарбонатов кальция и магния больше 7 за счет гидролиза солей с участием аниона слабой кислоты. В точке эквивалентности раствор имеет слабокислую реакцию, обусловленную диссоциацией слабой угольной кислоты: Н2СО3 D НСО3- + Н+
Порядок выполнения работы 1. Отберите в коническую колбу пипеткой 100 мл исследуемой водопроводной воды или 10 мл приготовленной жесткой воды и добавьте 2-3 капли метилоранжа. 2. Оттитруйте воду рабочим раствором HCl до оранжевой окраски индикатора. Титрование повторите до получения сходящихся результатов. Результаты титрования запишите в таблицу (см. образец в лаб. раб 1). 3.Вычислите молярную концентрацию эквивалента солей Ca2+ и Mg2+ в воде:
4. Вычислите временную жесткость воды: Жвр.(Н2О) = СЭ(солей) · 1000,(ммоль/л) 5. Вычислите относительную ошибку определения Жвр.
Лабораторная работа № 3 МЕТОД КОМПЛЕКСОНОМЕТРИИ
Комплексонометрия - титриметрический метод анализа, основанный на реакциях комплексообразования определяемых ионов металлов с некоторыми органическими веществами, в частности, с комплексонами. Комплексоны - это аминополикарбоновые кислоты и их производные (соли). Реакции комплексообразования ионов металлов с комплексонами протекают быстро и стехиометрически количественно. В титриметрическом анализе широко используется один из представителей класса комплексонов - динатриевая соль этилендиаминтетрауксусной кислоты (Na2H2ЭДТА). Этот комплексон часто называют также трилоном Б или комплексоном III:
Трилон Б со многими катионами металлов образует прочные растворимые в воде внутрикомплексные соединения (хелаты). При образовании хелата катионы металла замещают два атома водорода в карбоксильных группах трилона Б и образуют координационные связи с участием атомов азота аминогрупп. Образование комплексного соединения можно представить схемой: Me2+ + H2ЭДТА2- ® [MeЭДТА]2- + 2 H+ Точку эквивалентности в процессе комплексонометрического титрования устанавливают с помощью металлохромных индикаторов, которые образуют с титруемыми ионами металлов растворимые окрашенные комплексные соединения, устойчивость которых меньше, чем устойчивость комплексных соединений тех же катионов с трилоном Б. Известно много металлохромных индикаторов. Некоторые из них универсальны, в частности, эриохром черный Т. При рН= 7-11 анион этого индикатора (HInd2-) имеет синюю окраску. С катионами металлов (Ca2+, Mg2+, Zn2+ и др.) в слабощелочном растворе (рН= 8-10) он образует комплексные соединения винно-красного цвета по схеме: Me2+ + HInd2- ↔ MeInd- + H+ синий винно-красный При титровании исследуемого раствора трилоном Б эти комплексные соединения разрушаются, так как ионы металла связываются трилоном Б в более прочный комплекс, а освобождающиеся анионы индикатора переходят в раствор, сообщая ему синюю окраску:
MeInd- + H2ЭДТА2- ↔ [MeЭДТА]2- + HInd2- + H+ винно-красный бесцветный бесцветный синий Кн([CaInd]-) = 3,9.10-6 Кн([CaЭДТА]2-) = 2,7.10-11 Кн([MgInd]-) = 1,0.10-7 Кн([MgЭДТА]2-) = 2,0.10-9 Для более полного протекания реакций комплексообразования (связывания образующихся ионов Н+) к исследуемому раствору при титровании добавляют аммиачный буферный раствор (NH4OH + NH4Cl), рН» 9. Лабораторная работа № 4 МЕТОДЫ РЕДОКСИМЕТРИИ
Методы редоксиметрии основаны на применении реакций окисления-восстановления. Рабочими растворами в редоксиметрии являются растворы окислителей или восстановителей. Следовательно, этими методами можно проводить количественные определения восстановителей и окислителей. Необходимым условием протекания окислительно-восстановительной реакции является наличие разности потенциалов (редокс-потенциалов) у реагирующих пар (пара - окисленная и восстановленная форма окислителя или восстановителя). Зная величины стандартных редокс-потенциалов (Ео) реагирующих пар, можно судить о направлении окислительно-восстановительных реакций. Окисленная форма пары с большим стандартным редокс-потенциалом является окислителем по отношению к восстановленной форме пары с меньшим потенциалом. Редокс-потенциал какой-либо пары зависит от концентраций окисленной и восстановленной форм, реакции среды, температуры и т.д. Его можно рассчитать по уравнению Нернста: E = Eo + где [Oк.] - концентрация окисленной формы; [Восст.] - концентрация восстановленной формы; n - количество электронов, участвующих в полуреакции. Реакция используется в количественном анализе, если разность потенциалов реагирующих пар (ЭДС системы) имеет значение 0,4-0,5 В. Методы редоксиметрии, в зависимости от используемых титрантов, могут подразделяться на: 1. Перманганатометрия. Титрант - раствор перманганата калия KMnO4. Индикатор - избыточная капля титранта. 2. Иодометрия. Титрант - раствор свободного иода I2 или тиосульфата натрия Na2S2O3. Индикатор - крахмал. 3. Дихроматометрия. Титрант - раствор дихромата калия K2Cr2O7. Методы применяются как для прямых, так и для косвенных определений.
И восстановителей При вычисления молярных масс эквивалентов окислителей и восстановителей исходят из числа электронов, которые присоединяет или отдает в данной реакции один моль вещества. Для нахождения молярной массы эквивалента окислителя (восстановителя) нужно его молярную массу разделить на число принятых (отданных) электронов в данной полуреакции. Например, в реакции окисления сульфата железа (II) перманганатом калия в кислой среде: 2 KMnO4 + 10 FeSO4 + 8 H2SO4 = 2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + 8 H2O 1 êMnO4- + 8 H+ + 5 e ® Mn2+ + 4 H2O 5 ê Fe2+ - e à Fe3+ ион MnO4- как окислитель принимает пять электронов, а ион Fe2+ как восстановитель отдает один электрон. Поэтому для расчета молярных масс эквивалентов окислителя и восстановителя их молярные массы следует разделить на пять и на один, соответственно. MЭ(KMnO4) = МЭ(FeSO4) = В реакции окисления сульфита натрия перманганатом калия в нейтральной среде: 2 KMnO4 + 3 Na2SO3 + H2O = 2 MnO2 + 3 Na2SO4 + 2 KOH 2 êMnO4- + 2 H2O + 3 e à MnO2 + 4 OH- 3 êSO32- + 2 OH- + 2 e à SO42- + H2O ион MnO4- принимает только три электрона, а ион восстановителя SO32- отдает два электрона, следовательно: MЭ(KMnO4) = Из приведенных примеров видно, что молярные массы эквивалентов окислителей и восстановителей зависят от условий проведения реакций и определяются исходя из соответствующих полуреакций.
ПЕРМАНГАНАТОМЕТРИЯ
Метод основан на окислительно-восстановительных реакциях, в которых окислителем является перманганат-ион MnO4-. Перманганат калия проявляет окислительные свойства в кислой, нейтральной и щелочной средах. Однако его окислительная активность в кислой среде (Ео = 1,51 В) гораздо выше, чем в нейтральной (Ео = 0,59 В) и щелочной (Ео = 0,56 В) средах. Поэтому титрование перманганатом калия проводят в кислых средах.При восстановлении перманганат-ионов в кислой среде образуются почти бесцветные ионы Mn2+, что позволяет легко фиксировать точку эквивалентности. Полуреакция восстановления иона MnO4- в кислой среде может быть представлена следующей полуреакцией: MnO4- + 8 H+ + 5`e ® Mn2+ + 4 H2O Перманганатометрия используется не только для количественного определения восстановителей, но и окислителей. Восстановители обычно определяются методом прямого титрования раствором перманганата калия, окислители - методом обратного титрования. В этом случае раствором перманганата калия оттитровывают избыток восстановителя, приливаемого к окислителю. Индикатором в этом методе служит сам рабочий раствор - перманганат калия. Одна избыточная капля КMnO4 окрашивает бесцветный титруемый раствор в бледно-розовый цвет. Лабораторная работа № 6 ИОДОМЕТРИЯ
Иодометрия - метод объемного анализа, основанный на окислительно-восстановительных реакциях, которые связаны с восстановлением I2 до иодид-ионов I- или окислением иодид-ионов I- до свободного I2: I2 + 2 e ® 2 I- -иод расходуется 2 I- - 2 e ® I2 -иод образуется Свободный иод является относительно слабым окислителем. Его стандартный потенциал (Ео (I2/2I-) = + 0,54 В) находится приблизительно в середине полной таблицы окислительно-восстановительных потенциалов. Восстановители, имеющие стандартный электродный потенциал меньше, чем 0,54 В (например, Na2S2O3, и др.) могут быть окислены иодом; Окислители, стандартный электродный потенциал которых больше, чем +0,54 В (например, KMnO4, K2Cr2O7, Cu2+ и др.) будут окислять иодид-ионы. Таким образом, метод иодометрии может применяться для определения как окислителей, так и восстановителей. При проведении титрования необходимо учитывать, что I2 проявляет окислительные свойства только в средах, близких к нейтральной. В кислых растворах иодид-ионы легко окисляются до свободного иода даже кислородом воздуха (особенно под воздействием света), а в щелочной среде иод диспропорционирует с образованием I- и IO- - ионов. Рабочими растворами в методе иодометрии являются не только раствор иода (окислитель), но и раствор тиосульфата натрия (восстановитель). Обычно используют 0,1 или 0,05 моль/л рабочий раствор I2. Однако, иод малорастворим в воде (насыщенный раствор содержит ~ 0,03% по массе иода), поэтому для приготовления рабочего раствора иода пользуются его хорошей растворимостью в концентрированных растворах KI (не ниже 10% по массе), сопровождающейся образованием комплексного соединения K[I3]: I2 + KI ® K[I3] Комплексный ион [I3]-, имея малую константу устойчивости, легко диссоциирует на I- -ион и I2 и в растворах ведет себя так же, как и I2. Рабочий раствор иода в лабораториях часто готовят из фиксаналов (фиксанал - стандартный раствор высокой концентрации в запаянных ампулах заводского изготовления) путем разбавления содержимого ампулы в мерных колбах соответствующего объема (объем и число молей эквивалентов вещества в данном объеме указываются на ампуле). В связи с тем, что реакции с участием свободного иода идут медленно, для определения сильных окислителей обычно не используют метод прямого титрования. Для количественного определения сильных окислителей методом иодометрии проводят титрование заместителя. В этом случае к раствору окислителя (определяемого вещества) добавляют избыток раствора иодида калия KI. Окислитель вытесняет из него эквивалентное количество свободного иода I2. Выделившийся иод оттитровывают восстановителем - стандартным раствором тиосульфата натрия, и определяют содержание окислителя в анализируемом растворе. Индикатором в иодометрии служит свежеприготовленный 1 %-ный раствор крахмала. При взаимодействии его с иодом протекают два процесса: адсорбция иода на поверхности молекул крахмала и образование комплексного соединения синего цвета - иодкрахмала. Для уменьшения адсорбции при титровании окислителя крахмал добавляют в титруемый раствор в конце титрования, когда основное количество иода уже прореагировало.
Лабораторная работа № 8 СТАНДАРТИЗАЦИЯ РАСТВОРА ТИОСУЛЬФАТА НАТРИЯ, Na2S2O3
Кристаллическому тиосульфату натрия соответствует форм
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 2797; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.02 с.) |






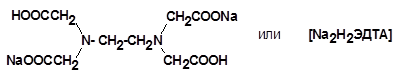


 MЭ(Fe2+) = M(Fe2+) = 55,85 г/моль
MЭ(Fe2+) = M(Fe2+) = 55,85 г/моль MЭ(Na2SO3) =
MЭ(Na2SO3) = 



