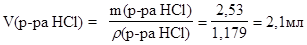Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Титрование сильной кислоты сильным основаниемСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
HCl + NaOH ® NaCl + H2O H+ + OH- ® H2O В точке эквивалентности образуется соль сильной кислоты и сильного основания, которая не подвергается гидролизу. Реакция среды будет нейтральной (рН=7). В данном случае индикатором может служить лакмус.
Титрование слабой кислоты сильным основанием CH3COOH + NaOH ® CH3COONa + H2O CH3COOH + OH- ® CH3COO- + H2O Образующаяся соль слабой кислоты и сильного основания в растворе подвергается гидролизу: CH3COO- + HOH ® CH3COOH + OH- Точка эквивалентности в этом случае будет находиться в щелочной среде, поэтому следует применять индикатор, меняющий окраску при рН>7, например, фенолфталеин.
Титрование слабого основания сильной кислотой NH4OH + HCl ® NH4Cl + H2O NH4OH + H+ ® NH4+ + H2O Образующаяся соль в растворе подвергается гидролизу: NH4+ + HOH ® NH4OH + H+ Точка эквивалентности будет находиться в кислой среде, поэтому можно применять метилоранж.
Лабораторная работа № 1 ПРИГОТОВЛЕНИЕ И СТАНДАРТИЗАЦИЯ РАСТВОРА HCl Лабораторная работа состоит из двух частей: 1. Приготовление 250 мл 0,1 моль/л раствора соляной кислоты из концентрированного раствора кислоты. 2. Стандартизация раствора HCl или установление точной концентрации приготовленного раствора соляной кислоты методом титрования ее раствором щелочи, концентрация которой известна. Приготовление 250 мл 0,1 моль/л раствора соляной кислоты С помощью ареометра определите плотность выданного Вам концентрированного раствора соляной кислоты (допустим, что r = 1,179 г/мл). По таблице плотности растворов (приложение табл. 3) найдите массовую долю кислоты в этом растворе (w = 36%). Рассчитайте какой объем 36% раствора HCl Вам нужно взять для приготовления 250 мл 0,1 моль/л раствора. Молярная масса эквивалента HCl равна 36,46 г/моль, поэтому в 250 мл 0,1 моль/л раствора должно содержаться 0,912 г безводной HCl: m (HCl) = MЭ · СЭ · V = 36,46 · 0,1 · 0,25 = 0,912 г Масса 36% раствора HCl, содержащая это количество кислоты, равна:
Объем исходного раствора кислоты можно найти по формуле:
Отмерьте маленьким мерным цилиндром рассчитанный объем (» 2,0 мл)36% раствора соляной кислоты и перелейте в большой цилиндр. Доведите объем раствора до 250 мл дистиллированной водой, слейте его в склянку на 250 мл и перемешайте.
Стандартизация раствора HCl Приготовьте для титрования штатив с бюреткой, коническую колбу, пипетку, маленькую воронку, стакан для слива растворов, индикатор - метилоранж. 1. Чистую бюретку промойте и затем заполните раствором соляной кислоты. Удалите воздух из нижнего конца бюретки. Выньте воронку и доведите уровень жидкости в бюретке до нулевого деления по нижнему краю мениска. 2. В колбу для титрования из общей бюретки отмерьте 10 мл титрованного раствора NaOH. 3. Добавьте цилиндром в колбу со щелочью 20-30 мл дистиллированной воды и 2-3 капли раствора метилоранжа. Раствор окрасится в желтый цвет. 4. Титруйте раствор NaOH раствором соляной кислоты, постепенно приливая раствор из бюретки при постоянном перемешивании. В конце титрования раствор из бюретки добавляйте по каплям. В точке эквивалентности раствор окрасится в оранжевый цвет. При добавлении лишней капли кислоты цвет раствора станет розовым. 5. Запишите в тетрадь объем соляной кислоты, пошедший на титрование щелочи. Титрование повторяйте до тех пор, пока не получите результаты, отличающиеся между собой не более чем на 0,1 мл. Результаты запишите в таблицу. 6. Зная объем щелочи (V(NaOH)), молярную концентрацию эквивалента щелочи (CЭ(NaOH)) и средний объем соляной кислоты (V(HCl)), пошедший на титрование, вычислите молярную концентрацию эквивалента соляной кислоты (СЭ(HCl)) и ее титр (Т(HCl)). Полученный раствор соляной кислоты будет служить титрантом (рабочим раствором) в дальнейших определениях.
_____________________________________________________ ОБРАЗЕЦ оформления лабораторной работы в Титриметрическом анализе Лабораторная работа №... Дата “Название лабораторной работы” Первичный стандарт - СЭ(NaOH) = …………моль/л Определяемое вещество (титрант) - СЭ(HCl) =?, T(HCl) =? Индикатор - метилоранж Условия титрования - (рН среды, нагревание и т.д.) Уравнение реакции (в молекулярной и ионно-молекулярной формах): Результаты эксперимента заносятся в таблицу:
V ср. (HCl) = Вычисления:
Лабораторная работа № 2
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 1100; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.54.210 (0.006 с.) |