
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кривые титрования в редоксиметрииСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
При оксидиметрическом титровании вследствие изменения концентраций участвующих в реакции веществ происходит непрерывное изменение окислительно-восстановительного потенциала системы (Е) подобно тому, как при кислотно-основном титровании всё время изменяется рН раствора. В связи с этим кривые титрования в редоксиметрии строят в координатах – величина редокс-потенциала как функция объёма добавленного титранта (рис. 41). Причём значения точек для построения такой кривой титрования можно измерить экспериментально с помощью потенциометрии или рассчитать теоретически по уравнению Нернста. Как следует из рисунка 41, сперва редокс-потенциал системы при добавлении рабочего раствора изменяется медленно и незначительно, но в области точки эквивалентности при переходе от раствора недотитрованного на 0,1% к перетитрованному на 0,1%, потенциал изменяется резко и скачкообразно. Причём чем больше разность стандартных потенциалов титранта и исследуемого раствора, тем больше скачок титрования. Для оксидиметрического титрования можно использовать такие окислительно-восстановительные пары, у которых разность их стандартных редокс-потенциалов (∆Е = Е0(окислителя) – Е0(восстановителя)) не меньше 0,4В. В противном случае отсутствует резкий скачок потенциала вблизи точки эквивалентности. На величину скачка титрования будут оказывать влияние и все те факторы, от которых зависят значения электродных потенциалов окислителя и восстановителя. Так, например, если в реакции, протекающей при титровании, принимают участие протоны или гидроксильные ионы, то ход кривой титрования станет определяться и значением рН системы. В то же время, исходные концентрации титруемого вещества и титранта не будут оказывать влияния на вид кривой титрования. Наличие резкого скачка на кривой титрования позволяет определить точку эквивалентности непосредственно с помощью потенциометрических измерений или использовать для этих целей определённые окислительно-восстановительные (редокс) индикаторы, окраска которых изменяется в зависимости от величины потенциала системы. Способы определения точки эквивалентности В редоксиметрии точку эквивалентности можно определить с помощью различных инструментальных методов (например, потенциометрически) либо визуально. Визуальное обнаружение конечной точки титрования может быть проведено по изменению окраски одного из участников протекающей реакции, либо с помощью индикаторов. Например, в перманганатометрии критерием достижения точки эквивалентности обычно служит появление неисчезающей розовой окраски вследствие добавления к бесцветному титруемому раствору одной лишней капли ярко-малинового раствора KМnO4. Индикаторы, используемые для определения точки эквивалентности, могут быть специфическими либо окислительно-восстановительными. Специфические индикаторы реагируют на изменение концентрации одного из участников химической реакции, протекающей при титровании, образуя с ним нестойкое яркоокрашенное соединение. Оно легко может разрушаться при добавлении второго реагента. Например, в иодометрии для этих целей используют раствор крахмала, образующий с I2 соединение ярко-синего цвета. По исчезновении (в результате расходования I2) или возникновении (при добавлении лишней капли раствора I2) синей окраски судят о достижении точки эквивалентности. Окислительно-восстановительными, или редокс-индикаторами, называются вещества, которые изменяют свою окраску в зависимости от величины окислительно-восстановительного потенциала системы. Под действием окислителя или восстановителя в структуре молекулы редокс-индикатора происходят изменения, вызывающие возникновение новой окраски. Таким образом, в растворе редокс-индикатора существует равновесие между его окисленной и восстановленной формами, имеющими разную окраску, которое сдвигается при изменении потенциала системы: Indox + ne- ↔IndRed
где Indox – окисленная, а IndRed – восстановленная формы индикатора; n – число электронов, принимающих участие при переходе молекулы индикатора из одной формы в другую.
Потенциал такой индикаторной системы может быть рассчитан по уравнению Нернста:
где Е0 – стандартный электродный потенциал, возникающий в системе, когда молярные концентрации окисленной (с(Indox)) и восстановленной (с(IndRed)) форм индикатора будут равны друг другу.
Как и в случае индикаторов других типов, изменение окраски редокс-индикаторов происходит в некотором интервале изменения величины их электродного потенциала. Можно показать, что крайние значения этого интервала определяются соотношением:
Редокс-индикатор можно использовать в окислительно-восстановительном титровании, если его интервал перехода лежит внутри скачка редокс-потенциала системы на кривой титрования. Редокс-индикаторы могут быть двухцветными (каждая из его форм имеет свою специфическую окраску) и одноцветными (табл. 22). В первом случае в точке эквивалентности мы наблюдаем переход одной окраски раствора в другую. Во втором случае – исчезновение или возникновение окраски титруемого раствора.
Таблица 22. Некоторые окислительно-восстановительные индикаторы
Редокс-индикаторы бывают обратимыми и необратимыми. Первые могут изменять свою окраску в растворе в зависимости от величины электродного потенциала системы неограниченное число раз. Вторые изменяют свою окраску необратимо, например, при окислении разрушаются с образованием бесцветных продуктов, как индиго под действием гипохлоритов или нафтоловый сине-чёрный под действием ионов BrO3-. Перманганатометрия Перманганатометрическим титрованием называется титриметрический метод анализа, основанный на использовании в качестве титранта KМnO4. Перманганатометрическое титрование проводят чаще всего в кислой среде, реже – в нейтральной. Щелочные растворы KМnO4 используют для количественного определения некоторых органических соединений: спиртов, альдегидов. Во всех трёх случаях продукт восстановления иона МnO4– и редокс-потенциал системы различны:
а) МnO4– + 8H+ + 5ē = Mn2+ + 4H2O, E0(МnO4–/ Mn2+) = +1,58В, рН<4;
б) МnO4– + 2H2O + 3ē = MnO2↓ +4OH–, Е0(МnO4–/ MnO2) = +0,6В, рН≈5-8;
в) МnO4– + ē → МnO42–, Е0(МnO4–/МnO42–) = +0,54В, рН>9.
Таким образом, в кислой среде, окислительная активность KМnO4 является самой высокой, что позволяет при этих условиях определить гораздо большее число различных восстановителей, чем в нейтральной и щелочной средах. Кроме того, при титровании в нейтральной и слабощелочной средах образуется тёмно-бурый осадок MnO2, сильно затрудняющий фиксирование точки эквивалентности. Для создания кислой среды в перманганатометрии используют разбавленный раствор H2SO4 (c(H2SO4)) ≈ 1моль/дм3. Азотная кислота (особенно содержащая оксиды азота) сама является сильным окислителем и может, наряду с KМnO4, окислять определяемое вещество, что приведёт к получению заниженных результатов анализа. Соляная и другие галогеноводородные кислоты (HBr, HI) будут, наоборот, окисляться KМnO4:
2KМnO4 + 16 HCl → 5Cl2 +2MnCl2 + 2 KCl +8H2O
Продуктом восстановления иона МnO4– в кислой среде является бесцветный ион Mn2+, что очень удобно для определения точки эквивалентности. Рабочий раствор KМnO4 по точной навеске кристаллического вещества приготовить невозможно, т.к. в нём всегда содержится некоторое количество MnO2. Кроме того, MnO2 образуется при окислении органических соединений, присутствующих в окружающей среде, например в воздухе. В водных растворах концентрация KМnO4 со временем уменьшается, так как перманганат калия частично расходуется на окисление различных посторонних примесей (присутствующих даже в дистиллированной H2O) и самой воды.
4МnO4– + 2H2O → MnO2↓ + 3О2 + 4ОН–
Данная реакция протекает достаточно медленно, поэтому правильно приготовленный раствор KМnO4 можно хранить в течение нескольких недель. Обычно раствор KМnO4 готовят несколько больше заданной концентрации. Рассчитанную для этих целей навеску вещества взвешивают на технических весах. Перед установлением точной концентрации раствор KМnO4 кипятят в течение небольшого промежутка времени (≈10 минут), а затем после охлаждения выдерживают в тёмной посуде несколько дней, чтобы завершились процессы окисления органических веществ и других примесей, содержащихся в H2O. После этого раствор фильтруют через стеклянный фильтр для удаления образовавшегося MnO2 и затем титруют рабочим раствором дигидрата щавелевой кислоты H2C2O4·2H2O или её натриевой соли Na2C2O4 (приготовленным по точной навеске вещества) в соответствии с уравнением:
2KМnO4 + 5H2C2O4 +3H2SO4 = 2MnSO4 + 10CO2 +K2SO4 +8H2O
Данная реакция протекает медленно, поэтому на начальном этапе её проводят при нагревании (около 700С). Также она является автокаталитической – роль катализатора выполняют образующиеся ионы Mn2+. К концу титрования их накапливается большое количество и реакция с достаточной скоростью начинает протекать и при обычных условиях. Перегревать раствор H2C2O4 (тем более доводить его до кипения) нельзя, т.к. растворенное вещество при этом будет частично разрушаться:
H2C2O4
Вместо нагревания к раствору щавелевой кислоты можно добавить определенное количество горячей H2O с таким расчётом, чтобы температура смеси стала равной приблизительно Индикаторы в перманганатометрическом титровании обычно не используются. В их роли выступает раствор KМnO4, имеющий интенсивную фиолетовую окраску. Конечную точку титрования обнаруживают по исчезновению окраски раствора KМnO4 (если к нему прибавляют из бюретки исследуемый раствор) или, наоборот, появлению неисчезающей слабо-розовой окраски при добавлении одной лишней капли выступающего в роли титранта раствора KМnO4. Не рекомендуется оставлять раствор KМnO4 в бюретках на длительное время. Метод перманганатометрии широко применяют на практике для определения окислителей и восстановителей, при этом используют все приёмы титрования: прямое, обратное и заместительное. Для определения восстановителей (Н2О2, ионов Fe2+ и др.) используют прямое титрование в сернокислой среде:
5Н2О2 + 2KМnO4 + 3H2SO4 = 2MnSO4 +K2SO4 +5O2 +8H2O
При определении сильных восстановителей, окисляющихся кислородом воздуха, применяют метод замещения. Например, для определения ионов Сr2+ к анализируемому раствору вначале добавляют в избытке ионы Fe3+, а затем образовавшиеся в результате протекания реакции:
Сr2+ + Fe3+→ Сr3+ + Fe2+
ионы Fe2+ титрируют стандартным раствором KМnO4. При определении окислителей используют обратное титрование. Для этого к определённому объёму анализируемого раствора (например K2Cr2O7) прибавляют точный, но заведомо избыточный объём раствора восстановителя (Na2C2O4, FeSO4 и др.). При этом исследуемый окислитель полностью расходуется:
K2Cr2O7 + 6FeSO4 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Избыток не прореагировавшего восстановителя оттитровывают рабочим раствором KМnO4:
2KМnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 +5Fe2(SO4)3 + K2SO4 +8Н2O
Обратное титрование применяют для определения органических веществ, т.к. при их прямом титровании в щёлочной среде реакция протекает медленно, а образующийся ион МnO42– имеет интенсивную зелёную окраску, что делает невозможным точное фиксирование конца титрования. Иодометрия Метод иодометрии основан на окислительно-восстановительной реакции, связанной с превращением I2 в ионы I-, и наоборот:
I2 + 2ē ↔ 2I-; E0(I2/2I–) = +0,54В. окислитель восстановитель
Данное уравнение записано в упрощенном виде. На практике для увеличения растворимости I2 в воду добавляют определённое количество KI. При этом иод реагирует с иодид-ионами, образуя трииодид-ионы:
I2 + I– = I3–
которые и выступают в роли окислителя. Однако для простоты и удобства в уравнениях реакций, как правило, записывают не ион I3–, а молекулярный иод (I2). Тем более, что образование иона I3- лишь незначительно сказывается на величине стандартного редокс-потенциала системы. Иодометрия не имеет такого широкого применения, как перманганатометрия, т.к. I2 является достаточно слабым окислителем (величина его стандартного редокс-потенциала равна +0,54В) и вследствие этого может вступать в реакцию лишь с ограниченным кругом веществ, обладающих достаточно сильными восстановительными свойствами. В титриметрии используют не только окислительные свойства I2, но и восстановительные – ионов I–. Следовательно, иодометрический метод можно применять как для определения достаточно сильных восстановителей, так и для определения окислителей. Методы, основанные на прямом окислении веществ раствором I2, иногда называют иодиметрическими. Методы, в которых определяемое вещество восстанавливается за счет действия ионов I–, а выделившийся при этом I2 титруется стандартным раствором восстановителя, называются иодометрическими. Данная классификация соблюдается не строго. Обе группы методов, как правило, носят одно общее название – иодометрия. Иод, выделившийся в результате окисления ионов I–, обычно количественно титруют тиосульфатом натрия Na2S2O3:
2Na2S2O3 + I2 = Na2S4O6 + 2 NaI
Рабочие растворы I2 и Na2S2O3 являются стандартизированными, т.е. их точная концентрация устанавливается после приготовления путём титрования другим раствором, титр которого уже известен. Кристаллический иод не является стандартным веществом вследствие его летучести. Взвешенную на технических весах навеску I2 растворяют в воде, содержащей KI. Полученный раствор должен храниться в герметически закрытой посуде из тёмного стекла и прохладном помещении. Первое условие необходимо для того, чтобы за счёт действия кислорода воздуха не проходило окисление ионов I– до I2. 4I– + O2 + 4H+ = 2I2 + 2 H2O
Данная реакция катализируется катионами некоторых металлов и действием света. Второе условие необходимо выполнять для предотвращения испарения I2 из раствора вследствие его летучести. Точный титр приготовленного раствора иода устанавливается с помощью стандартизированного раствора тиосульфата натрия. По точной навеске твёрдой соли нужной концентрации раствор Na2S2O3, как правило, не готовят, поскольку кристаллогидрат Na2S2O3 · 5Н2О без разложения можно хранить только в специальных условиях (например, над насыщенным раствором CaCl2). В свежеприготовленном растворе тиосульфата натрия протекают различные сложные химические превращения, часть которых ведёт к увеличению его титра, а часть – к уменьшению. Так, например, под действием углекислого газа тиосульфат частично превращается в сульфит:
S2O32– + CO2 + H2O = HSO3– + HCO3– + S,
на окисление которого затрачивается в 2 раза больше I2:
HSO3– + I2 + H2O = HSO4– + 2I– + 2H+
чем на окисление такого же количества тиосульфата. Вследствие этого титр Na2S2O3 по иоду будет возрастать. Уменьшение титра Na2S2O3 при хранении происходит за счёт его окисления кислородом воздуха:
2S2O32– + O2 = 2SO42– + 2S↓
Другой причиной уменьшения титра является разложение тиосульфата микроорганизмами (тиобактериями), которые всегда находятся в воздухе и легко попадают в раствор. В связи с этим приготовленный раствор Na2S2O3 выдерживают несколько суток в закрытом сосуде в защищённом от света месте, а затем его точный титр устанавливают с помощью растворов K2Cr2O7 и KI по методу замещения. Для предотвращения взаимодействия Na2S2O3 с CO2 сосуды с его раствором защищают хлоркальциевыми трубками, а для подавления развития тиобактерий добавляют некоторое количество антисептика: фенола, бензоата натрия, хлороформа и др. В качестве индикатора в иодометрии используют водный раствор крахмала, который с I2 образует неустойчивое соединение ярко-синего цвета. При титровании восстановителей рабочим раствором I2 точка эквивалентности определяется по появлению неисчезающего синего окрашивания. При титровании I2 рабочим раствором Na2S2O3 завершение реакции определяется по исчезновению синей окраски от одной избыточной капли раствора Na2S2O3. Крахмал необходимо добавлять к раствору в конце титрования, когда содержание I2 в растворе становится небольшим. Крахмал, добавленный к раствору с высокой концентрацией I2, становится чёрным и разрушается, что затрудняет установление точки эквивалентности. Титрование в иодометрии стараются проводить при пониженной температуре, чтобы избежать частичной потери I2 из-за его летучести. Кроме того, в этих условиях чувствительность крахмала к I2 будет максимальной. Для предотвращения протекания различных побочных реакций рН раствора не должен быть больше 9. Иодометрическое определение восстановителей проводят по методу прямого или обратного титрования. При прямом титровании рабочим раствором является раствор I2, который по каплям добавляют в исследуемый раствор до наступления точки эквивалентности.
Na2SO3 + I2 + H2O → Na2SO4 + 2HI.
В тех случаях, когда прямое титрование осложнено, для определения восстановителя применяют метод обратного титрования с использованием двух рабочих растворов: I2 и Na2S2O3. К определяемому восстановителю добавляют точно отмеренный объём раствора I2, но взятого в избытке по отношению к восстановителю. Остаток непрореагировавшего I2 титруют раствором Na2S2O3. Окислители в иодометрии определяются с помощью метода замещения. Для этого к подкисленному H2SO4 раствору KI, взятому в избытке, добавляют точно отмеренный объём исследуемого раствора окислителя, например K2Cr2O7:
K2Cr2O7 +6KI + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O
Выделившийся I2 титруют затем раствором тиосульфата натрия.
Практическая часть занятия Лабораторная работа: Определение молярной концентрации эквивалентов и титра KMnO4 по рабочему раствору щавелевой кислоты.
Ход работы: В основе метода лежит следующая окислительно-восстановительная реакция:
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 = 2 MnSO4 + K2SO4 + 10 CO2 + 8 H2O
Для титрования заполняют бюретку раствором перманганата калия (KMnO4). В колбу для титрования пипеткой отмеряют 5 мл рабочего раствора щавелевой кислоты и 5 мл 2 н. раствора H2SO4. Колбу нагревают, не доводя до кипения, и горячий раствор титруют раствором перманганата калия из бюретки. Титрование повторяют 3 раза. Вычисляют средний объем KMnO4, пошедший на титрование. Находят молярную концентрацию эквивалентов и титр раствора KMnO4. Расчет: вычисляют средний объем (V) KMnO4,, пошедший на титрование с точностью до сотых
V ср. (KMnO4) = V1+V2+V3 = мл Находят молярную концентрацию эквивалентов c[1/z*(KMnO4)] по формуле:
(с точностью до четвертого знака после запятой)
Т(Х) =
(с точностью до четвертой значащей после запятой) Расчеты заносят в таблицу
Вывод: __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Дата ________ Подпись преподавателя_______________
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 1856; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.184.195 (0.015 с.) |

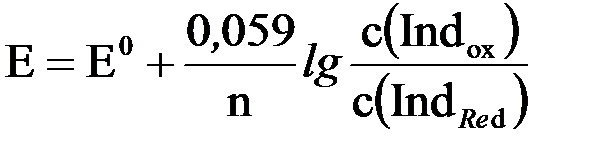
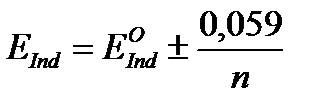
 H2O + CO2 + CO
H2O + CO2 + CO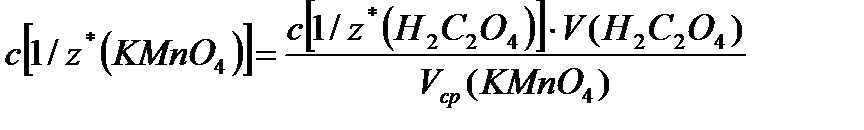 =
=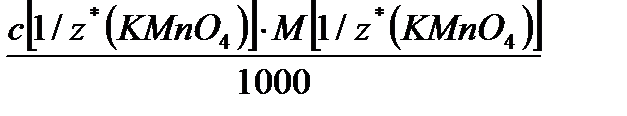 =
=


