
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготовление рабочего титрованного раствора перманганата калияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте По свойствам кристаллический перманганат калия не относится к исходным веществам, поэтому точную концентрацию раствора устанавливают путем титрования. Рабочим раствором, пригодным для установления точной концентрации, может быть приготовленный титрованный раствор щавелевой кислоты, являющийся восстановителем. В процессе получения титрованного раствора необходимо учесть, что это вещество лучше растворяется в горячей воде, а концентрация его в первые дни после приготовления изменяется вследствие медленного окисления перманганатом восстановителей и микроорганизмов, возможно содержащихся в дистиллированной воде. Некоторые продукты этой химической реакции, например, MnO2 нерастворимы. Учитывая сказанное, можно рекомендовать порядок приготовления рабочего титрованного раствора: 1) рассчитать массу перманганата калия, необходимую для получения 1 л раствора с молярной концентрацией эквивалента равной 0,1 моль/л; 2) взвесить кристаллический перманганат калия на технохимических весах с точностью до 0,01 г, перенести в мерную колбу на 1,0 л, растворить в горячей дистиллированной воде, охладить, довести объем раствора до метки дистиллированной водой комнатной температуры; 3) дать раствору постоять в темном месте 7-10 дней; 4) раствор перманганата отфильтровать через стеклянный фильтр или слить с помощью сифона в чистую сухую склянку; 5) для установления точной концентрации раствора приготовить 100 мл 0,1 моль/л раствора щавелевой кислоты. Способ приготовления известен из работы по методу нейтрализации. В отчете по данной работе записать расчет навески, все данные при взвешивании на аналитических весах, расчет точной концентрации; 6) установить точную концентрацию раствора по рабочему титрованному раствору щавелевой кислоты путем титрования в кислой среде. Для титрования раствором перманганата калия желательно применять бюретки со стеклянными кранами, т.к. перманганат окисляет резину. Бюретку ополоснуть и заполнить раствором перманганата калия. В коническую колбу для создания кислой среды налить 5 мл раствора серной кислоты (1:4) и 10 мл приготовленного раствора щавелевой кислоты. Жидкость в колбе нагреть на водяной бане до 70-800С, но не до кипения, т.к. при кипении щавелевая кислота разлагается. Нагревание раствора ускоряет реакцию. Прикапывание раствора перманганата к горячему раствору щавелевой кислоты проводить сначала медленно, т.к. первые капли обесцвечиваются не сразу. Не следует прибавлять в раствор следующую каплю, пока предыдущая не обесцветится. Как только в растворе образуется небольшое количество ионов двухвалентного марганца, который является катализатором в этой реакции, дальнейшее обесцвечивание происходит почти мгновенно. Титрование заканчивается в тот момент, когда содержимое колбы примет едва заметный на белом фоне бледно-розовый цвет от одной капли раствора KMnO4. Титрование повторить трижды, записать V1(KMnO4), V2(KMnO4), V3(KMnO4) и вычислить средний объем; 7) составить уравнение реакции, протекающей при титровании. Коэффициенты подобрать одним из известных способов; 8) вычислить нормальную концентрацию и титр раствора перманганата калия; 9) установленный титрованный раствор KMnO4 сохранить для выполнения следующих лабораторных работ; 10) для самоконтроля составить уравнение реакций при титровании перманганатом в нейтральной и щелочной средах. Вычислить для этих случаев молярные массы эквивалентов перманганата калия.
Расчётные формулы:
1)
2) 3)
4)
5 Лабораторная работа № 4
Перманганатометрия. Определение массовой доли железа в соли Мора
Метод перманганатометрии может быть использован для количественного определения железа в его соединениях. Сущность реакции заключается в том, что соли, содержащие Fe2+, окисляются перманганатом в соли, содержащие Fe3+. Окислительно-восстановительная реакция осуществляется в кислой среде при обычной температуре. 5.1 Ход определения
5.1.1 Составить уравнение реакции между сульфатом железа (II) и перманганатом калия в сернокислой среде. 5.1.2 Пользуясь составленным уравнением, определить числа эквивалентности, факторы эквивалентности, молярные массы эквивалентов сульфата железа (II), перманганата калия и Fe2+. 5.1.3 Составить уравнение реакции между солью Мора, имеющей формулу 5.1.4 Вычислить молярную массу эквивалента соли Мора. 5.1.5 Рассчитать навеску соли Мора для получения 100 мл 0,01 моль/л раствора. 5.1.6 Взвесить на аналитических весах навеску соли Мора, близкую к рассчитанной, с точностью до 0,0001 г. Числовые данные при взвешивании записать. 5.1.7 Перенести навеску соли Мора в мерную колбу на 100 мл по всем правилам перенесения навески. 5.1.8 Растворить навеску в небольшом количестве воды, добавить 5 мл раствора серной кислоты (1:4) для предупреждения гидролиза соли Мора и довести объем раствора до метки водой. Закрыть пробкой и тщательно перемешать. 5.1.9 Путем разбавления в 10 раз приготовить ~ 0,01 моль/л раствор перманганата калия из полученного ранее ~ 0,1 моль/л раствора. Вычислить концентрацию разбавленного раствора. 5.1.10 Оттитровать не менее трех раз по 10 мл раствора соли Мора раствором перманганата калия, добавляя каждый раз по 5 мл раствора серной кислоты (1:4). Записать затраченные объемы раствора перманганата и вычислить средний. 5.1.11 Вычислить нормальную концентрацию раствора соли Мора, и массу Fe2+ в объеме раствора 100 мл. 5.1.12 Вычислить массовую долю Fe2+ в соли Мора по результатам титрования и теоретическую, сравнить их и результаты сравнения выразить в виде абсолютной и относительной ошибок.
Расчётные формулы:
1) 2) 3) 4) 5) 6) 7)
6 Лабораторная работа № 5
|
||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 1485; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.006 с.) |

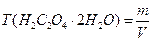



 и перманганатом калия в сернокислой среде.
и перманганатом калия в сернокислой среде.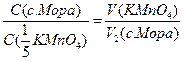





 %
%


