
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вычисления в объёмном анализеСодержание книги
Поиск на нашем сайте
Вычисления в объемном анализе основаны на законе эквивалентов, законе сохранения массы вещества при химических реакциях, законе постоянства состава веществ. В расчетах используются числовые данные периодической системы химических эквивалентов Д.И. Менделеева или справочные таблицы относительных молекулярных масс элементов и различных формульных единиц.
Примеры типовых задач и расчетов в объемном анализе 1.4.1.1 Какова масса двухводного кристаллогидрата щавелевой кислоты, необходимая для приготовления 200 мл раствора с молярной концентрацией эквивалента 0,1500 моль/л? Каков титр этого раствора? Решение: 1) М (Н2С2О4 · 2Н2О) = 126,07 г/моль (из справочной таблицы) 2) Z = 2, 1/z = ½ = 0,5 3) m (Н2С2О4 · 2Н2О) = C (½Н2С2О4 · 2Н2О) · M (½Н2С2О4 · 2Н2О) · V (Н2С2О4) m (Н2С2О4 · 2Н2О) = 0,1500 моль/л · ½ · 126 г/моль · 0,2 л = 1,8900 г. 4) Т (Н2С2О4 · 2Н2О) = m (Н2С2О4 · 2Н2О)/ V (Н2С2О4) Т (Н2С2О4 · 2Н2О) = 1,8900 г/200 мл = 0,009450 г/мл Ответ: m (Н2С2О4 · 2Н2О) = 1,8900 г. Т (Н2С2О4 · 2Н2О) = 0,009450 г/мл.
1.4.1.2 Каковы титр и нормальная концентрация раствора серной кислоты, если на титрование 15,0 мл его затрачено 13,7 мл титрованного раствора гидроксида калия с молярной концентрацией 0,1304 моль/л? Решение: 1) H2SO4 + 2 KOH → K2SO4 + 2 H2O Z (H2SO4) = 2, 1/z = ½ = 0,5 Z (KOH) = 1 По закону эквивалентов: V (H2SO4)/ V (KOH) = C (KOH) / C (½H2SO4) C (½H2SO4) = 0,1304 моль/л · 13,7 мл / 15,0 мл = 0,1191 моль/л 2) Т(H2SO4) = С (½H2SO4) · М(½H2SO4) / 1000, М (½H2SO4) = ½ · 98,078 = 49, 039 г/моль Т (H2SO4) = 0,1191 моль/л · 49,03 г/моль/1000 мл = 0,005836 г/мл Ответ: C (½H2SO4) = 0,1191 моль/л Т (H2SO4) = 0,005836 г/мл
1.4.1.3 Из навески 0,6172 г иодида калия приготовили 100 мл раствора. На титрование 15,0 мл этого раствора затрачено 25,0 мл раствора нитрата серебра, молярная концентрация которого равна 0,0204 моль/л. Вычислите массовую долю иода в иодиде калия по результатам титрования и теоретическую (для сравнения). Решение: KI + AgNO3 → AgI + KNO3
1) T (AgNO3/I-) = C(AgNO3) · M(I-)/1000 T (AgNO3/I-) = 0,0204 моль/л · 127 г/моль /1000 мл = 0,002591 г/мл 2) m (I-) = T (AgNO3/I-) · V (AgNO3) · V1 (KI)/V2 (KI) m (I-) = 0,002591 г/мл · 25 мл · 100 мл / 15 мл = 0,4318 г. 3) W (I-) = m (I-) / m (KI) по результатам титрования: W (I-)прак. = 0,4318 г / 0,6172 г = 0,6996 или 69,96 % W (I-)теор. = М (I-) / М (KI) W (I-)теор. = 127 г/моль / 166 г/моль = 0,7651 или 76,51 % Ответ: W (I-)прак. = 0,6996 или 69,96 % W (I-)теор. = 0,7651 или 76,51 %
1.4.2 Решить самостоятельно задачи 1.4.2.1 Какова молярная концентрация раствора хлорида натрия, если для приготовления 500 мл раствора бала взята на аналитических весах навеска 0,5850 NaCl х.ч.? Каков титр этого раствора? Какова нормальная концентрация этого раствора? 1.4.2.2 Какова масса сульфата меди в 2,5 л раствора с молярной концентрацией эквивалента 0,25 моль/л? Вычислите для безводной соли и пятиводного кристаллогидрата. 1.4.2.3 Каковы титр и молярная концентрация эквивалента раствора нитрита натрия, если при титровании его в кислой среде на 10,0 мл раствора нитрита натрия затрачено 12,5 мл раствора перманганата калия, молярная концентрация эквивалента которого равна 0,0800 моль/л? При титровании протекает реакция:
5NO2 - + 2MnO4- + 6H+ → 5NO3- + 2Mn2+ +3H2O
Лабораторная работа № 1 Метод нейтрализации. Приготовление рабочего титрованного раствора кислоты. Приготовление рабочего титрованного раствора щелочи. Определение концентрации кислоты по щелочи Введение
Метод нейтрализации или кислотно-основное титрование является одним из методов объемного химического количественного анализа аналитической химии. Основан на применении реакций нейтрализации в целях анализа. Сущность реакции нейтрализации заключается во взаимодействии протонов с гидроксид-ионами, в результате чего образуются слабодиссоциирующие молекулы: H+ + OH-
Методом нейтрализации устанавливают концентрацию растворов кислот по рабочим титрованным растворам щелочей; концентрацию растворов щелочей по рабочим титрованным растворам кислот; концентрацию растворов гидролитически кислых солей (11) по рабочим титрованным растворам щелочей; концентрацию гидролитически щелочных солей (11) по рабочим титрованным растворам кислот. Так как реакции нейтрализации обычно не сопровождаются каким-либо внешним эффектом, точку эквивалентности при титровании фиксируют на глаз по изменению цвета добавленного к титруемому раствору индикатора. В методе нейтрализации применяются кислотно-основные индикаторы, изменение цвета которых происходит при изменении реакции среды. Наиболее распространенными индикаторами метода нейтрализации являются:
Таблица 1 – Кислотно-основные индикаторы
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 544; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.58.68 (0.008 с.) |


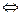 H2O
H2O


