
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Выражения и расчёта концентрацииСодержание книги
Поиск на нашем сайте
1.3.1 По роли в объемном анализе различают рабочий и анализируемый растворы. Рабочий раствор – это раствор того вещества, по концентрации которого устанавливают концентрацию анализируемого раствора. Растворы с известной концентрацией в весовом анализе называют титрованными, т.е. с известным титром. Титр – один из способов выражения концентрации растворов, показывает, сколько г (или мг) растворенного вещества содержится в 1 мг раствора. Обозначается Т, измеряется в г/мл или мг/мл. Является одним из видов массовой концентрации. 1.3.2 По способу нахождения точной концентрации титрованные растворы делят на два типа: а) приготовленные; б) установленные. Приготовленным раствором называется титрованный раствор, точная концентрация которого становится известной в процессе его приготовления по точной навеске, взятой на аналитических весах, и точному объему раствора:
T (A) = m (A)/V (A), г/мл
Навеску вещества рассчитывают заранее. Масса вещества, необходимая для приготовления заданного объема раствора, заданной концентрации (или масса вещества, содержащаяся в любом объеме раствора известной концентрации) прямо пропорциональна концентрации, молярной массе или молярной массе эквивалента растворенного вещества и объему раствора.
Кроме титра рабочего раствора
часто применяют в расчетах титр рабочего раствора вещества (А) по определяемому иону или веществу (Х). Титр рабочего раствора по определяемому иону или веществу показывает, сколько г (мг) определяемого иона или вещества (Х) взаимодействует с 1 мл рабочего титрованного раствора вещества (А). Обозначается Т(А/Х). Например, Т(KMnO4/Fe2+) показывает, сколько г взаимодействует Fe2+ взаимодействует с 1 мл рабочего титрованного раствора KMnO4; Т(AgNO3/Cl-) – титр рабочего раствора нитрата серебра по иону Cl-, показывает, сколько г Cl- взаимодействует с 1 мл рабочего титрованного раствора. Титр Т(А/Х) вычисляется: 1) по затраченному на титрование объему рабочего раствора
где m (Х)– масса титруемого иона или вещества, г V (А)– эквивалентный объем рабочего раствора, мл 2) по концентрации рабочего титрованного раствора:
например:
Вещества, пригодные для получения приготовленных растворов, называется исходным и должны удовлетворять следующим требованиям: а) быть химически чистым, б) иметь определенный химический состав, выражающийся одной формулой и не изменяющийся как при хранении веществ, так и при приготовлении раствора. Круг таких веществ ограничен (поваренная соль; кристаллогидрат щавелевой кислоты, некоторые квасцы, бура и др.). Большинство же веществ в той или иной мере изменяются со временем, поэтому для получения из них растворов с точной концентрацией вначале готовят раствор примерной концентрации, а затем устанавливают его точную концентрацию путем титрования. Установленным раствором называется титрованный раствор, точная концентрация которого стала известной из расчетов по результатам титрования. Расчет ведут на основании закона эквивалентов, который в применении к веществам, взаимодействующим в растворенном состоянии, можно сформулировать так: “Объемы растворов реагирующих веществ в точке эквивалентности обратно пропорциональны нормальным концентрациям этих веществ (или молярным концентрациям эквивалентов этих веществ)”. Для реакции
А + В → С + Д
где V (A), V (B) – объемы рабочего и анализируемого раствора в точке эквивалентности; C (1/zA), C (1/zB)– нормальные концентрации рабочего и анализируемого раствора (или молярные концентрации эквивалентов этих веществ). Нормальная или молярная концентрация эквивалентов показывает, какое количество вещества эквивалента содержится в единице объема раствора. Измеряется в моль/л, ммоль/мл. Рекомендуется применять целые единицы измерения (моль/л), т.к. пропорциональные дробные величины численно с ними совпадают. Например, если имеется раствор с молярной концентрацией эквивалентов 0,1 моль/л, то его концентрация в ммоль/л также равна 0,1. Нормальная концентрация (молярная концентрация эквивалента) находится отношением количества вещества эквивалента (n моль), содержащегося в растворе, к объему, этого раствора (V л).
или учитывая, что
можно вычислить:
|
|||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 235; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.104.222 (0.006 с.) |

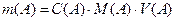 г, мг;
г, мг; г, мг.
г, мг.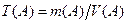 (г/мл)
(г/мл) , г/мл,
, г/мл, ,
, (г\мл)
(г\мл) (г/мл)
(г/мл)






