
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Жёсткости воды методом комплексонометрииСодержание книги
Поиск на нашем сайте 11.1 Сущность метода комплексообразования Метод комплексообразования или комплексонометрическое титрование – один из методов объёмного химического количественного анализа аналитической химии, основан на применении в целях анализа реакции образования комплексных соединений при взаимодействии анализируемых ионов с некоторыми органическими реагентами, называемыми комплексонами. В аналитической химии часто применяют комплексон – двунатриевую соль этилендиаминтетрауксусной кислоты
HOOCH2C CH2COOH
NaOOCH2C CH2COONa
Это вещество имеет другие названия: комплексон III, трилон Б. При взаимодействии этого комплексона с ионами металлов образуются внутрикомплексные соединения (хелаты), например:
NaOOCH2C CH2COONa
Комплексоны катионов металлов с трилоном Б, как правило, бесцветны и очень прочны, они могут образовываться даже, если первоначально ион-комплексообразователь связан в другой, менее прочный комплекс. Метод комплексонометрии с использованием в качестве рабочего раствора трилона Б называют трилонометрией.
11.2 Применение метода трилонометрии для определения общей Жесткости воды В производственной практике комплексонометрическое титрование применяют для определения общей жесткости природной воды. Общая жесткость воды равна сумме количеств миллимоль – эквивалентов ионов кальция и магния, содержащихся в 1 л воды. Для определения общей жёсткости к исследуемому объёму воды добавляют буферную смесь для создания щелочной среды (рН = 10) и раствор индикатора, например, эриохрома чёрного Т. Эриохром чёрный Т – органический азокраситель, диссоциирующий по типу кислоты, сокращенно его формулу можно представить как Н3Ind. В растворе индикатора при рН = 7 – 11 устанавливается равновесие:
Н3Ind ↔ НInd 2- + 2 Н+
Этот индикатор с катионами Са2+ и Mg2+, образует винно-красные комплексные анионы, что можно схематично представить так:
Са2+ + НInd 2- → СаInd - + Н+ синий красный
Mg2+ + НInd 2- → MgInd - + Н+ синий красный
При титровании раствором трилона Б красные комплексы, как менее прочные, разрушаются, катионы кальция и магния переходят в более прочные бесцветные комплексы с трилоном Б, анионы же индикатора (синего цвета) освобождаются:
СаInd - + Na2[H2Yr] → Na2[CaYr] + НInd 2- + Н+ (16) красный бесцвет. Бесцвет. синий
MgInd - + Na2[H2Yr] → Na2[MgYr] + НInd 2- + Н+ (17) красный бесцвет. Бесцвет. Синий
В приведённых схемах: Yr – символ этилендиаминтетраацетат-иона
-OOCH2C CH2COO-
-OOCH2C CH2COO-
НInd 2- - символ аниона индикатора, соответствующего его диссоциации в щелочной среде. Из приведённых схем 1 и 2 видно, что в точке эквивалентности красная окраска раствора комплексов кальция и магния с индикатором сменяется синей окраской, которую придают раствору анионы индикатора.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 569; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.006 с.) |




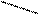 N ─ CH2 ─ CH2 ─ N
N ─ CH2 ─ CH2 ─ N О
О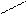

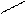
 О О О
О О О


 Н2С CH2
Н2С CH2


