
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Количественный анализ.: Методические указания кСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Кафедра химии
Л.М. Рагузина, А.В. Стряпков, Е.В.Сальникова, Ж.П. Анисимова
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНОМУ ПРАКТИКУМУ Рекомендовано к изданию Редакционно-издательским советом государственного образовательного учреждения высшего профессионального образования «Оренбургский государственный университет»
Оренбург 2003
ББК 24.4 я73 К - 60 УДК 54.062 (075.8)
Рецензент кандидат технических наук, доцент Т.Ф. Тарасова
Количественный анализ.: Методические указания к К 60 лабораторному практикуму./ Л.М. Рагузина, А.В. Стряпков, Е.В. Сальникова, Ж.П. Анисимова. - Оренбург: ГОУ ОГУ, С. Лабораторный практикум состоит из лабораторных работ по количественному анализу. Каждая работа включает теоретическое изложение материала, описание методики проведения опытов, расчётные формулы. Методические указания предназначены для выполнения лабораторного практикума по дисциплине “Аналитическая химия” для студентов специальностей 011000, 320700, 271400, 270300, 270500, 271200, 271100, 2709000.
ББК 24.4 я73
© Рагузина Л.М., 2003 Стряпков А.В., Сальникова Е.В., Анисимова Ж.П., © ГОУ ОГУ, 2003
Содержание
1 Введение в объёмный анализ.................................... 4 2 Лабораторная работа № 1 Метод нейтрализации. Приготовление рабочего титрованного раствора кислоты. Приготовление рабочего титрованного раствора щелочи. Определение концентрации кислоты по щелочи............ 12 3 Лабораторная работа № 2 Метод нейтрализации. Количественное определение карбонатов и бикарбонатов в растворе....................................... 15 4 Лабораторная работа № 3 Оксидиметрия. Перманганатометрия. Приготовление рабочего титрованного раствора перманганата калия.........................18 5 Лабораторная работа № 4 Перманганатометрия. Определение массовой доли железа в соли Мора.........................................................21 6 Лабораторная работа № 5 Оксидиметрия. Иодометрия. Приготовление рабочего титрованного раствора тиосульфата натрия. Определение массовой доли меди в медном купоросе методом иодометрии............................23 Лабораторная работа № 6 Дихроматометрия..............................................27 Лабораторная работа № 7 Определение железа с трилоном Б............................... 29 9 Лабораторная работа № 8 Определение содержания уксусной кислоты в уксусе............... 30 10 Лабораторная работа № 9 Определение степени гидролиза методом измерения рН раствора......32 11 Лабораторная работа № 10 Метод комплексообразования. Трилонометрия. Определение общей жёсткости воды методом комплексонометрии...................... 34 12 Лабораторная работа № 11 Определение зольности пищевых кислот......................... 38 13 Лабораторная работа № 12 Весовой анализ. Определение массовой доли бария в хлориде бария... 39 14 Требования к рабочему журналу................................. 42 Список использованных источников..............................43
Введение в объёмный анализ
Характеристика и методы объёмного анализа Объёмный анализ
Объемным (титриметрическим) анализом называют метод количественного химического анализа аналитической химии, основанный на точном измерении объемов растворов реагирующих между собой нацело веществ. Основной операцией объемного анализа является титрование – постепенное приливание одного раствора, находящегося в бюретке, к точно известному объему другого вещества, находящемуся в колбе, до точки эквивалентности. Точкой эквивалентности считают момент титрования, в который все вещество из раствора в колбе прореагирует. Точка эквивалентности фиксируется глазом аналитика по изменению внешнего вида (например, цвета) растворов реакционной системы или специально добавленного индикатора. По точно измеренным объемам растворов двух реагирующих веществ и известной концентрации одного из них рассчитывают неизвестную концентрацию другого раствора. Расчеты основывают на законе эквивалентов: “Вещества вступают в химические реакции друг с другом строго определенными массами их эквивалентов”. Например для реакции: А + В → С + Д
выражение закона эквивалентов:
m (A) /m (B) = M (1/z A)/ M (1/z B)
Можно закон сформулировать упрощенно: “Количества эквивалентов прореагировавших веществ равны между собой”, что для той же реакции
А + В → С + Д
можно записать: n (1/z A) = n (1/z B)
Методы объёмного анализа
В зависимости от типа химической реакции, используемой в целях анализа, различают методы объемного анализа: - методы, основанные на применении реакций обмена (метод нейтрализации или кислотно-основное титрование; метод осаждения); - методы, основанные на применении реакций окисления-восстановления (оксидиметрия или редоксметрия, или окислительно-восстановительное титрование); - методы, основанные на применении реакций комплексообразования (комплексонометрия или комплексонометрическое титрование).
Мерные колбы
Мерные колбы представляют собой плоскодонные сосуды шарообразной или грушеобразной формы с узким длинным горлом. На горле имеется кольцевая метка, до которой нужно заполнить колбу, чтобы объем раствора был равен обозначенному на фабричном клейме. Наиболее часто применяют мерные колбы емкостью: 1000, 500, 250, 200, 100 и 50 мл. Объем на колбе обозначают в мл при температуре +20ºС. Мерные колбы применяют для приготовления известных объемов растворов точной или примерно заданной концентрации, реже – для отмеривания заданных объемов растворов или воды. Мерная колба тарируется на заполнение. В мерных колбах не разрешается нагревать, длительное время хранить растворы или осуществлять в них химические реакции, так как при этом стекло стенок колбы выщелачивается и объем изменяется.
Пипетки Пипетки представляют собой длинные стеклянные трубки малых диаметров, имеющие оттянутый носик и, возможно, расширение в средней части трубки. Применяются для точного отмеривания и перенесения из одного сосуда в другой небольших объемов растворов. При этом пипетки с расширением (пипетки Мора) имеют одну кольцевую метку для перенесения только одного объема раствора. Цилиндрические пипетки градуированы на мл и их доли и предназначены для перенесения разных объемов растворов (в пределах градуировки). Градуированные пипетки малого объема (1-2 мл), изготовленные из стеклянной трубки очень малого диаметра с ценой деления 0,01-0,05 мл, называются микропипетками и применяются при работе с очень малыми объемами растворов. Пипетки при изготовлении градуируются на слив, поэтому объем раствора, вылитого из пипетки, соответствуют градуировке.
Бюретки
Бюретки представляют собой градуированные по высоте на мл и их доли длинные стеклянные трубки с оттянутым носиком, перед которым имеется стеклянный кран или отрезок резинового шланга, перекрываемые металлическим зажимом снаружи или стеклянным шариком внутри. Бюретка предназначена для титрования или для отмеривания небольших порций растворов в серийных анализах.
Примеры типовых задач и расчетов в объемном анализе 1.4.1.1 Какова масса двухводного кристаллогидрата щавелевой кислоты, необходимая для приготовления 200 мл раствора с молярной концентрацией эквивалента 0,1500 моль/л? Каков титр этого раствора? Решение: 1) М (Н2С2О4 · 2Н2О) = 126,07 г/моль (из справочной таблицы) 2) Z = 2, 1/z = ½ = 0,5 3) m (Н2С2О4 · 2Н2О) = C (½Н2С2О4 · 2Н2О) · M (½Н2С2О4 · 2Н2О) · V (Н2С2О4) m (Н2С2О4 · 2Н2О) = 0,1500 моль/л · ½ · 126 г/моль · 0,2 л = 1,8900 г. 4) Т (Н2С2О4 · 2Н2О) = m (Н2С2О4 · 2Н2О)/ V (Н2С2О4) Т (Н2С2О4 · 2Н2О) = 1,8900 г/200 мл = 0,009450 г/мл Ответ: m (Н2С2О4 · 2Н2О) = 1,8900 г. Т (Н2С2О4 · 2Н2О) = 0,009450 г/мл.
1.4.1.2 Каковы титр и нормальная концентрация раствора серной кислоты, если на титрование 15,0 мл его затрачено 13,7 мл титрованного раствора гидроксида калия с молярной концентрацией 0,1304 моль/л? Решение: 1) H2SO4 + 2 KOH → K2SO4 + 2 H2O Z (H2SO4) = 2, 1/z = ½ = 0,5 Z (KOH) = 1 По закону эквивалентов: V (H2SO4)/ V (KOH) = C (KOH) / C (½H2SO4) C (½H2SO4) = 0,1304 моль/л · 13,7 мл / 15,0 мл = 0,1191 моль/л 2) Т(H2SO4) = С (½H2SO4) · М(½H2SO4) / 1000, М (½H2SO4) = ½ · 98,078 = 49, 039 г/моль Т (H2SO4) = 0,1191 моль/л · 49,03 г/моль/1000 мл = 0,005836 г/мл Ответ: C (½H2SO4) = 0,1191 моль/л Т (H2SO4) = 0,005836 г/мл
1.4.1.3 Из навески 0,6172 г иодида калия приготовили 100 мл раствора. На титрование 15,0 мл этого раствора затрачено 25,0 мл раствора нитрата серебра, молярная концентрация которого равна 0,0204 моль/л. Вычислите массовую долю иода в иодиде калия по результатам титрования и теоретическую (для сравнения). Решение: KI + AgNO3 → AgI + KNO3
1) T (AgNO3/I-) = C(AgNO3) · M(I-)/1000 T (AgNO3/I-) = 0,0204 моль/л · 127 г/моль /1000 мл = 0,002591 г/мл 2) m (I-) = T (AgNO3/I-) · V (AgNO3) · V1 (KI)/V2 (KI) m (I-) = 0,002591 г/мл · 25 мл · 100 мл / 15 мл = 0,4318 г. 3) W (I-) = m (I-) / m (KI) по результатам титрования: W (I-)прак. = 0,4318 г / 0,6172 г = 0,6996 или 69,96 % W (I-)теор. = М (I-) / М (KI) W (I-)теор. = 127 г/моль / 166 г/моль = 0,7651 или 76,51 % Ответ: W (I-)прак. = 0,6996 или 69,96 % W (I-)теор. = 0,7651 или 76,51 %
1.4.2 Решить самостоятельно задачи 1.4.2.1 Какова молярная концентрация раствора хлорида натрия, если для приготовления 500 мл раствора бала взята на аналитических весах навеска 0,5850 NaCl х.ч.? Каков титр этого раствора? Какова нормальная концентрация этого раствора? 1.4.2.2 Какова масса сульфата меди в 2,5 л раствора с молярной концентрацией эквивалента 0,25 моль/л? Вычислите для безводной соли и пятиводного кристаллогидрата. 1.4.2.3 Каковы титр и молярная концентрация эквивалента раствора нитрита натрия, если при титровании его в кислой среде на 10,0 мл раствора нитрита натрия затрачено 12,5 мл раствора перманганата калия, молярная концентрация эквивалента которого равна 0,0800 моль/л? При титровании протекает реакция:
5NO2 - + 2MnO4- + 6H+ → 5NO3- + 2Mn2+ +3H2O
Лабораторная работа № 1 Метод нейтрализации. Приготовление рабочего титрованного раствора кислоты. Приготовление рабочего титрованного раствора щелочи. Определение концентрации кислоты по щелочи Введение
Метод нейтрализации или кислотно-основное титрование является одним из методов объемного химического количественного анализа аналитической химии. Основан на применении реакций нейтрализации в целях анализа. Сущность реакции нейтрализации заключается во взаимодействии протонов с гидроксид-ионами, в результате чего образуются слабодиссоциирующие молекулы: H+ + OH-
Методом нейтрализации устанавливают концентрацию растворов кислот по рабочим титрованным растворам щелочей; концентрацию растворов щелочей по рабочим титрованным растворам кислот; концентрацию растворов гидролитически кислых солей (11) по рабочим титрованным растворам щелочей; концентрацию гидролитически щелочных солей (11) по рабочим титрованным растворам кислот. Так как реакции нейтрализации обычно не сопровождаются каким-либо внешним эффектом, точку эквивалентности при титровании фиксируют на глаз по изменению цвета добавленного к титруемому раствору индикатора. В методе нейтрализации применяются кислотно-основные индикаторы, изменение цвета которых происходит при изменении реакции среды. Наиболее распространенными индикаторами метода нейтрализации являются:
Таблица 1 – Кислотно-основные индикаторы
Лабораторная работа № 2
Бикарбонатов в растворе Метод нейтрализации используется не только для определения концентраций кислот и щелочей, но также для количественного определения солей, которые в растворе при гидролизе создают либо кислую, либо щелочную среду.
Лабораторная работа № 3 Перманганатометрия
Оксидиметрия или окислительно-восстановительное титрование является одним из методов объемного химического количественного анализа аналитической химии. Оксидиметрия основана на использовании в целях анализа окислительно-восстановительных реакций. Перманганатометрия – это частный случай оксидиметрии, основанный на применении раствора перманганата калия в качестве рабочего титрованного раствора. Перманганат калия KMnO4 в химических реакциях служит окислителем. Растворы перманганата калия окрашены в розово-фиолетовый цвет, присущий аниону MnO4-. Под действием восстановителей степень окисления марганца (+7) в перманганате уменьшается до (+2) в кислой среде, до (+4) в нейтральной или слабощелочной или до (+6) в щелочной среде. При этом образуются соединения марганца иного вида, чем перманганат. Например, в нейтральной среде образуется осадок MnO2, а в щелочной – зеленый раствор MnO42-. Титрование раствором перманганата чаще всего осуществляют в кислой среде, в которой ионы, имеющие розово-фиолетовый цвет, под действием восстановителей восстанавливаются до бесцветных катионов. Каждая капля раствора, взятого в качестве титранта, обесцвечивается до тех пор, пока в титруемом растворе еще имеется восстановитель. Как только восстановитель в титруемом растворе прореагирует полностью, одна лишняя прибавленная капля перманганата окрасит раствор в колбе в бледно- розовый цвет. Таким образом, для фиксирования точки эквивалентности при титровании в перманганатометрии специальный индикатор не требуется. Индикатором является лишняя после точки эквивалентности капля раствора. Перманганатометрия используется для количественного определения восстановителей. Сущность метода иодометрии Иодометрия – один из окислительно-восстановительных методов объемного анализа, основан на использовании окислительно-восстановительных свойств иода. Атомы иода, принимая электроны от веществ – восстановителей, ведут себя в реакциях как окислители:
I2o +2е → 2 I-
Анионы иода, напротив, легко отдают свои электроны веществам-окислителям и, следовательно, играют в реакциях роль восстановителей:
2 I- -2e → I2o
Эти окислительно-восстановительные свойства иода и его ионов лежат в основе иодометрии. Например, при взаимодействии иода с тиосульфатом натрия происходит реакция:
I2 + 2Na2S2O3 → 2NaI + Na2S4O6 – тетратионат натрия S2O3 2- - 2е → S4O6 2- Z(Na2S2O3) = 1 I2 +2е → 2 I- Z (I2) = 2
Внешним признаком рассмотренной реакции является обесцвечивание бурого раствора иода. Точка эквивалентности при титровании устанавливается с помощью крахмала, играющего в этом случае роль индикатора (переход от синего к бесцветному). Иодометрия чаще применяется для количественного определения окислителей. Титрование ведется, как правило, методом заместителя. Титрование заместителя применяют, когда нет подходящей реакции или индикатора для прямого титрования. При титровании заместителя анализируемое вещество (А) и рабочее вещество (Р) между собой непосредственно не взаимодействуют. Вначале одно из них, например, А, взаимодействует с каким-то третьим веществом (В), взятым в избытке, а получившийся при этом взаимодействии продукт (Пзам.) (он и есть заместитель) оттитровывается рабочим раствором (Р). Т.е. количество вещества эквивалента анализируемого раствора равно количеству вещества эквивалента рабочего раствора, хотя они между собой непосредственно не взаимодействуют. В качестве рабочего раствора в иодометрии применяют титрованный рабочий раствор тиосульфата натрия, установка точной концентрации которого осуществляются по перманганату калия тоже методом иодометрии. Рассмотрим метод титрования заместителя на примере установки точной концентрации раствора по перманганату калия. Тиосульфат натрия, как активный восстановитель, нельзя титровать по ряду причин раствором такого сильного окислителя, как перманганат калия. Однако тиосульфат натрия с успехом можно применять для титрования слабого окислителя.
Лабораторная работа № 6
Дихроматометрия В дихроматометрии стандартным раствором является дихромат калия. Его можно приготовить по точной навеске, так как он легко очищается перекристаллизацией из водного раствора и долго сохраняет концентрацию постоянной. В кислой среде дихромат является сильным окислителем и применяется для определения восстановлением до хрома (III):
Cr2O72- +14H+ +6e = 2Cr3+ +7H2O
E0 (Cr2O72-/2Cr2+) = 1,33 В
При титровании дихроматом калия применяют окислительно – восстановительные индикаторы – дифениламин, дифенилбензидин и т.п.
Определение железа
Титрование железа (II) основано на реакции:
6Fe2++Cr2O72-+14H+= 6Fe3++2Cr3++7H2O
В процессе титрования повышается концентрация ионов железа (III), и потенциал системы Fe3+/ Fe2+ возрастает, что приводит к преждевременному окислению индикатора дифениламина. Если прибавить к титруемому раствору фосфорную кислоту, то окраска индикатора резко изменяется в конечной точке титрования. Фосфорная кислота понижает окислительно – восстановительный потенциал системы Fe3+/ Fe2+, образуя устойчивый комплекс с ионами железа (III). Растворы солей железа (II) часто содержат ионы железа (III), поэтому перед титрованием ионы железа (III) необходимо восстановить. Для восстановления применяют металлы (цинк, кадмий и др.), SnCl2, H2S, SO2 и другие восстановители.
Реагенты: Дихромат калия, К2Cr2О7, 0,0500 М стандартный раствор. Соляная кислота, НCl, концентрированная с пл. 1,17. Серная кислота, Н2SО4, концентрированная с пл. 1,84. Фосфорная кислота, Н3РО4, концентрированная с пл. 1,7. Цинк металлический, гранулированный. Индикатор дифениламин, 1%-ный раствор в конц. Н2SО4.
Ход определения. Аликвотную часть анализируемого раствора 10,00 мл пипеткой переносят в коническую колбу для титрования вместимостью 100 мл, добавляют 5 мл конц. НCl. Закрывают колбу маленькой воронкой, вносят 3 – 4 гранулы металлического цинка и нагревают на песочной бане (реакция должна идти не очень бурно) до обесцвечивания раствора и полного осаждения цинка. Охлаждают под струёй холодной воды, добавляют 3 – 4 мл Н2SО4, охлаждают, добавляют 5 мл Н3РО4, 15 – 20 мл дистиллированной воды, 2 капли раствора дифениламина и тируют раствором дихромата калия до появления синей окраски.
Лабораторная работа № 7 Лабораторная работа № 8 Лабораторная работа № 9 Жесткости воды В производственной практике комплексонометрическое титрование применяют для определения общей жесткости природной воды. Общая жесткость воды равна сумме количеств миллимоль – эквивалентов ионов кальция и магния, содержащихся в 1 л воды. Для определения общей жёсткости к исследуемому объёму воды добавляют буферную смесь для создания щелочной среды (рН = 10) и раствор индикатора, например, эриохрома чёрного Т. Эриохром чёрный Т – органический азокраситель, диссоциирующий по типу кислоты, сокращенно его формулу можно представить как Н3Ind. В растворе индикатора при рН = 7 – 11 устанавливается равновесие:
Н3Ind ↔ НInd 2- + 2 Н+
Этот индикатор с катионами Са2+ и Mg2+, образует винно-красные комплексные анионы, что можно схематично представить так:
Са2+ + НInd 2- → СаInd - + Н+ синий красный
Mg2+ + НInd 2- → MgInd - + Н+ синий красный
При титровании раствором трилона Б красные комплексы, как менее прочные, разрушаются, катионы кальция и магния переходят в более прочные бесцветные комплексы с трилоном Б, анионы же индикатора (синего цвета) освобождаются:
СаInd - + Na2[H2Yr] → Na2[CaYr] + НInd 2- + Н+ (16) красный бесцвет. Бесцвет. синий
MgInd - + Na2[H2Yr] → Na2[MgYr] + НInd 2- + Н+ (17) красный бесцвет. Бесцвет. Синий
В приведённых схемах: Yr – символ этилендиаминтетраацетат-иона
-OOCH2C CH2COO-
-OOCH2C CH2COO-
НInd 2- - символ аниона индикатора, соответствующего его диссоциации в щелочной среде. Из приведённых схем 1 и 2 видно, что в точке эквивалентности красная окраска раствора комплексов кальция и магния с индикатором сменяется синей окраской, которую придают раствору анионы индикатора.
Экспериментальная часть. Приборы и посуда: аналитические весы, тигли, муфельная печь. Реактивы: пищевая кислота, раствор нитрата аммония (NH4NO3), 10 %. Ход выполнения. В фарфоровый тигель, прокаленный до постоянной массы, вносят кислоту (2-3г), взвешивают на аналитических весах. Ставят в муфельную печь, осторожно прогревая тигель. Затем поставить в среднюю часть муфеля, прокаливают в течение часа. Вынимают тигель, немного охлаждают и содержимое смачивают 2 – 3 каплями раствора нитрата аммония, после чего продолжают прокаливание ещё минут 10 – 15. Охлаждают в эксикаторе до комнатной температуры, взвешивают, записав массу (m3’) прокаливание тигля в течение 5 – 10 минут повторяют до постоянной массы, каждый раз охлаждая в эксикаторе. Осаждение катиона бария
13.2.1 Приготовить раствор осадителя, смешав 30,0 мл дистиллированной воды и 3,0 – 5,0 мл. раствора серной кислоты С (½H2SO4) = 2 моль/л в стакане емкостью 100,0 мл. 13.2.2 Анализируемый раствор и раствор осадителя нагреть на плитке почти до кипения, но не кипятить. 13.2.3 Провести осаждение иона бария. Для этого медленно, при постоянном перемешивании приливать по каплям горячий раствор серной кислоты к горячему раствору хлорида бария. Небольшую порцию раствора осадителя оставить для последующей проверки полноты осаждения. При перемешивании стеклянной палочкой не касаться стенок и дна стакана. Палочку из раствора не вынимать до конца анализа. 13.2.4 Стакан с осадком поставит на горячую водяную баню и дать смеси отстояться. Осаждение из горячего раствора и постепенное охлаждение на бане способствует образованию крупных кристаллов. 13.2.5 Когда раствор над осадком станет совершенно прозрачным, сделать пробу на полноту осаждения, для чего по стенке стакана прилить 2 – 3 капли оставленного ранее раствора осадителя. Если помутнение раствора над осадком не происходит, катион бария полностью осажден. В противном случае провести доосаждение по п.п. 13.2.3 – 13.2.5. 13.2.6 Стакан с осадком (не вынимая стеклянной палочки) закрыть чистым листом бумаги, написав на листе шифр группы и фамилию. Оставить в таком виде до следующего занятия.
Требования к рабочему журналу При проведении лабораторных работ по аналитической химии большое внимание уделяется ведению лабораторных журналов. Студенты обязаны придерживаться определенных правил оформления рабочего журнала, заключающихся в следующем: 1) для журнала используется общая тетрадь, страницы нумеруются, проводятся поля; 2) записи ведутся подробно и аккуратно; 3) новая работа начинается с новой страницы; 4) каждая работа имеет название, соответствующее плану лабораторных занятий; на полях записывается дата выполнения; 5) в журнале после названия лабораторной работы приводятся краткие теоретические выкладки, методика работы, расчетные формулы, экспериментальные данные и результаты расчетов; 6) порядок записи должен соответствовать полностью порядку выполнения всех операций работы и расчетов согласно методическим указаниям; 7) все данные необходимо записывать сразу же в лабораторный журнал, а не отдельные листки, и обязательно чернилами; 8) ошибочно записанные числа, формулы, слова не переправляйте (!), а аккуратно перечеркните и рядом или над ними напишите правильно. Вырывать испорченный лист из журнала нельзя, его нужно перечеркнуть; 9) проводя расчеты по формулам, обязательно проводите в журнале подстановку всех числовых значений; 10) выделяйте полученные промежуточные значения концентраций, титров и конечные результаты анализа, подчеркивая их.
Кафедра химии
Л.М. Рагузина, А.В. Стряпков, Е.В.Сальникова, Ж.П. Анисимова
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНОМУ ПРАКТИКУМУ Рекомендовано к изданию Редакционно-издательским советом государственного образовательного учреждения высшего профессионального образования «Оренбургский государственный университет»
Оренбург 2003
ББК 24.4 я73 К - 60 УДК 54.062 (075.8)
Рецензент кандидат технических наук, доцент Т.Ф. Тарасова
Количественный анализ.: Методические указания к
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 567; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |


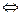 H2O
H2O


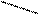 N ─ CH2 ─ CH2 ─ N
N ─ CH2 ─ CH2 ─ N


