
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение массовой доли меди в медном купоросе методом иодометрииСодержание книги
Поиск на нашем сайте
Йодометрическое определение меди в медьсодержащих веществах основано на взаимодействии катионов Cu2+ с анионом I-.
CuSO4 + KI → CuI + I2 + K2SO4 (5)
Выделившийся свободный I2 (заместитель Cu2+) титруется рабочим раствором тиосульфата натрия:
I2 + Na2S2O3 ↔ NaI + Na2S4O6 (6)
Схемы (5) и (6) запишите уравнениями реакций, подобрав коэффициенты любым известным способом. Пользуясь составленными уравнениями, выясните, чему равны числа эквивалентности сульфата меди (следовательно, и медного купороса), иона Cu2+ и тиосульфата натрия в этих реакциях. Из (5) и (6) следует:
n (1/zCu2+) = n (1/zI2) = n (1/zNa2S2O4)
Ход определения: 1) получить у преподавателя или лаборанта контрольный объем раствора медного купороса в мерную колбу на 100 мл и добавить 3 мл 2 н. раствора серной кислоты. Довести до метки водой, закрыть пробкой и тщательно перемешать; 2) в коническую колбу объемом 100 мл последовательно внести 10 мл 25%-го раствора иодида калия и точно 10 мл анализируемого раствора медного купороса; 3) накрыть смесь в колбе часовым стеклом и поставить в темное место на 10 мин для завершения реакции, т.е. до полного окисления иодид-иона в свободный иод; 4) выделившийся иод оттитровать раствором тиосульфата натрия до перехода темно-бурой окраски в соломенно-желтую; 5) прилить в колбу 3,0 мл раствора крахмала и быстро, но по каплям закончить титрование, признаком чего служит исчезновение синей окраски крахмала от одной избыточной капли тиосульфата; 6) замерить и записать объем затраченного на титрование раствора тиосульфата натрия; 7) повторить титрование еще 2 раза (п.п. 3-6); 8) вычислить средний объем раствора тиосульфата натрия, затраченный на титрование; 9) по закону эквивалентов вычислить нормальную концентрацию и титр раствора медного купороса; 10) вычислить массы Cu2+ и CuSO4·5H2O в контрольном растворе; 11) вычислить массовую долю меди в медном купоросе по результатам титрования; 12) вычислить теоретическую массовую долю меди в медном купоросе; 13) сравнить практически полученный результат и теоретическое значение массовой доли. Вычислить относительную ошибку определения; 14) подвести итог работы по форме:
Таблица 2 – Результаты определения
Расчётные формулы:
1) 2) 3) 4) 5) 7) Лабораторная работа № 6
Дихроматометрия В дихроматометрии стандартным раствором является дихромат калия. Его можно приготовить по точной навеске, так как он легко очищается перекристаллизацией из водного раствора и долго сохраняет концентрацию постоянной. В кислой среде дихромат является сильным окислителем и применяется для определения восстановлением до хрома (III):
Cr2O72- +14H+ +6e = 2Cr3+ +7H2O
E0 (Cr2O72-/2Cr2+) = 1,33 В
При титровании дихроматом калия применяют окислительно – восстановительные индикаторы – дифениламин, дифенилбензидин и т.п.
Определение железа
Титрование железа (II) основано на реакции:
6Fe2++Cr2O72-+14H+= 6Fe3++2Cr3++7H2O
В процессе титрования повышается концентрация ионов железа (III), и потенциал системы Fe3+/ Fe2+ возрастает, что приводит к преждевременному окислению индикатора дифениламина. Если прибавить к титруемому раствору фосфорную кислоту, то окраска индикатора резко изменяется в конечной точке титрования. Фосфорная кислота понижает окислительно – восстановительный потенциал системы Fe3+/ Fe2+, образуя устойчивый комплекс с ионами железа (III). Растворы солей железа (II) часто содержат ионы железа (III), поэтому перед титрованием ионы железа (III) необходимо восстановить. Для восстановления применяют металлы (цинк, кадмий и др.), SnCl2, H2S, SO2 и другие восстановители.
Реагенты: Дихромат калия, К2Cr2О7, 0,0500 М стандартный раствор. Соляная кислота, НCl, концентрированная с пл. 1,17. Серная кислота, Н2SО4, концентрированная с пл. 1,84. Фосфорная кислота, Н3РО4, концентрированная с пл. 1,7. Цинк металлический, гранулированный. Индикатор дифениламин, 1%-ный раствор в конц. Н2SО4.
Ход определения. Аликвотную часть анализируемого раствора 10,00 мл пипеткой переносят в коническую колбу для титрования вместимостью 100 мл, добавляют 5 мл конц. НCl. Закрывают колбу маленькой воронкой, вносят 3 – 4 гранулы металлического цинка и нагревают на песочной бане (реакция должна идти не очень бурно) до обесцвечивания раствора и полного осаждения цинка. Охлаждают под струёй холодной воды, добавляют 3 – 4 мл Н2SО4, охлаждают, добавляют 5 мл Н3РО4, 15 – 20 мл дистиллированной воды, 2 капли раствора дифениламина и тируют раствором дихромата калия до появления синей окраски.
Лабораторная работа № 7
|
||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 896; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.38.218 (0.006 с.) |





 6)
6) 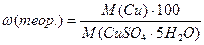
 ; 8)
; 8) 



