
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Жесткость питьевой артезианской воды после ее умягченияСодержание книги
Поиск на нашем сайте различными способами
Таблица 1.2. Эффективность умягчения воды на ионитах в зависимости от ее расхода
3. ЗАДАНИЕ
1. Определить жесткость: · питьевой воды сырой; · питьевой воды кипяченой и охлажденной; · питьевой воды сырой, обработанной содой (0,5 г · питьевой воды кипяченой и охлажденной, обработанной содой и осветленной; · дистиллированной воды. Определить жесткость воды в указанных пробах (в трех повторностях). Сделать выводы об эффективности различных методов умягчения и дать оценку жесткости воды по наличию солей постоянной и временной жесткости. 2. Определить эффективность умягчения воды методом ионного обмена. 3. Определить эффективность умягчения (обессоливания) воды при ее различном времени контактирования с ионитами. 4. Построить график зависимости
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Обессоливание и умягчение воды - общее и различие в методах обработки. 2. Требуется ли какая-либо дополнительная обработка воды перед ее катионированием и анионированием? 3. Самые дешевые и самые дорогие методы умягчения воды. Их эффективность. 4. Единицы измерения жесткости воды и их значения. 5. Что такое регенерация ионитов и как она осуществляется?
ТЕХНИКА БЕЗОПАСНОСТИ
1. Проверить исправность работы титровального прибора (индикатор света, работа перемешивающего устройства и пр.). 2. Проверить целостность стеклянной посуды. 3. Проверить работу водоструйного насоса. 4. Растворы отбирать соответствующей пипеткой. 5. Использовать в работе только чистую посуду.
ЛАБОРАТОРНАЯ РАБОТА № 3 Определение окисляемости природных И сточных вод
Цель работы – дать общую оценку качества воды (степени ее загрязнения) по перманганатной и бихроматной окисляемости.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Общую оценку загрязненности воды, как природной, так и сточной, можно достаточно быстро получить по ее окисляемости (ХПК – химическая потребность в кислороде). Под окисляемостью понимают количество кислорода, необходимое для окисления примесей, содержащихся в одном литре (дм3) исследуемой воды (мг О2/л). Окисляемость может быть общей, т.е. показывать количество всех веществ в воде, органических и минеральных, или «окисляемость с поправкой», если определяется содержание только органических веществ. На практике при анализе воды в качестве окислителя используют не кислород, а растворы таких сильных окислителей как перманганат калия ( Происхождение и содержание органических веществ, находящихся в природных водах, весьма разнообразны. Различны и их химические свойства по отношению к кислороду: одни вещества устойчивы к окислению, другие, наоборот, легко окисляются. Прямое определение органических веществ в природных водах является сложной и трудоемкой задачей. Поэтому пользуются более простыми косвенными методами. Метод перманганатной окисляемости дает представление о содержании в воде легко окисляющихся органических веществ. Метод бихроматной окисляемости соответствует полному окислению органических веществ (легко и трудно окисляющихся), за исключением некоторых белковых соединений. Обычно перманганатная окисляемость составляет 40–50 % от истинной окисляемости органических веществ, то есть полного окисления органического углерода до СО2. Повышенная окисляемость может указывать на загрязнение воды. Наименьшую окисляемость (до 1–2 мг/л О2 ) имеют глубокие подземные воды, относящиеся к 1-му классу. Окисляемость подземных вод, относящихся ко 2-му и 3-му классам, может быть повышена, но не более 5 и 15 мг/л О2соответственно. В грунтовых водах окисляемость обычно выше (до 2–4 мг/л), причем тем больше, чем выше цветность воды. Поэтому высокая окисляемость при небольшой цветности вероятнее указывает на загрязнение воды. В воде открытых водоемов окисляемость повышается до 5–6 мг/л в реках идо 6–8 мг/л в водохранилищах, достигая еще больших величин в водах болотного происхождения. Вода считается пригодной для хозяйственных и питьевых целей, если перманганатная окисляемость ее не превышает 3,0 мг/л О2. Установлено, что с повышением содержания в воде органических веществ увеличивается и ее бактериальное загрязнение. Необходимо помнить, что при определении окисляемости воды, как перманганатной, так и бихроматной, аналитик получает условные сведения о качестве воды, указывающие лишь на химическую природу загрязнителей и их косвенное количество по израсходованному окислителю. Конкретного ответа о качественном составе загрязнителей, присутствующих в воде, окисляемость не дает. В то же время это всегда и необходимо. Так для определения оценки качества воды для различных категорий водопользования окисляемость является важнейшим показателем, т.к. дает возможность очень быстро получить ответ об общем состоянии воды в исследуемом объекте.
1.1. Перманганатная окисляемость (метод Кубеля) Метод основан на окислении органических веществ, присутствующих в воде, 0,01н раствором перманганата калия в сернокислой среде при кипячении. Этим методом можно определить окисляемость в диапазоне от 0 до 100 мг О2/л, без разбавления. Максимальная определяемая окисляемость 10 мг О2/л. Определение перманганатной окисляемости основано на том, что КМnО4в кислой среде являясь сильным окислителем, реагирует с присутствующими в воде восстановителями (органические вещества, соли железа (II), нитраты). Ион МnО- 4 принимает при этом 5 электронов и переходит в двухвалентный катион Мn2+по уравнению:
Избыток КМnО 4 реагирует с вводимой в раствор щавелевой кислотой:
Не вступившая в реакцию щавелевая кислота оттитровывается КМnО4по приведенному уравнению. Определению мешают неорганические соединения (хлориды, сульфиды, нитриты, железо (II), которые могут окисляться в условиях анализа. Если они присутствуют в анализируемой воде, их кол-во необходимо определить отдельно и вычесть результат, пересчитанный на окисляемость, из окисляемости пробы воды. 1 мг H2SO4 соответствует 0,47 мг О2; 1 мг NO2 – 0,35 мг О2; 1 мг Fe+2 – 0,14 мг O2.
1.2. Бихроматная окисляемость
В сернокислой среде с помощью бихромата калия в присутствии солей серебра (в качестве катализатора) окисляется большинство органических веществ и часть минеральных. Поэтому бихроматную окисляемость называют «общая окисляемость» или «полная окисляемость». Определению мешают хлориды, влияние которых можно исключить добавлением в пробу сульфата ртути (II). Если необходимо определить содержание только органических веществ в пробе, то необходимо с помощью других известных методов определить в ней содержание минеральных веществ, а затем эту величину (ее кислородный эквивалент) вычесть из общей окисляемости.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Определение степени загрязнения воды перманганатным методом Кубеля (питьевая вода)
Анализируемая вода должна отстояться в течение 2 часов для выделения нерастворимых примесей. Затем отбирают 100 мл пробы и помещают в коническую колбу объемом 250 мл. Для создания кислой среды приливают 5 мл разбавленной (1:3) серной кислоты, а в качестве окислителя – 10 мл 0,01 н раствора перманганата калия. В колбу опускают стеклянный шарик, накрывают воронкой и ставят на плитку. Смесь должна закипеть через 5 мин, продолжительность кипения 10 мин. При кипении раствора внимательно следят за его окраской. Если розовое окрашивание перейдет в бурое или раствор обесцветится, это свидетельствует о недостатке окислителя. В таком случае анализ данной пробы прекращается и повторяется сначала, но уже с разбавленной пробой. Если в процессе кипения цвет раствора остается розовым, то по истечении 10 мин колбу снимают с плитки, убирают прикрывающую ее воронку и прибавляют 10 мл 0,01 н раствора щавелевой кислоты. Горячую обесцвеченную смесь титруют 0,01 н раствором перманганата калия до появления слабо розового окрашивания. Следует учитывать, что для получения точных результатов необходимо, чтобы при титровании концентрированных проб расходовалось не более 12 мл 0,01 н раствора Параллельно проводят холостой опыт со 100 мл дистиллированной воды (разбавляющей), который учитывает поведение окислителя в условиях анализа. При этом расход 0,01 н раствора перманганата калия не должен превышать 0,2 мл. Окисляемость по методу Кубеля вычисляется по формуле:
где
8 – молярная масса эквивалента кислорода, г/моль;
Результаты определения округляют с точностью до 0,1 мг при значении окисляемости от 0 до 10 мг
2.2. Определение степени загрязнения методом бихроматной окисляемости (сточная вода, загрязненная вода природных источников)
Для анализа необходимо отобрать 20 мл пробы, поместить ее в колбу со шлифом для кипячения. В колбу (при необходимости) добавить 0,4 г катализатора, 10 мл 0,25 н раствора бихромата калия. Смесь аккуратно перемешивают и осторожно приливают к ней 30 мл концентрированной серной кислоты. Затем к колбе с пробой присоединяют обратный холодильник и кипятят смесь в течение 2 часов. При этом необходимо следить за цветом кипящего раствора. Если он изменился от золотисто-оранжевого к буро-зеленоватому, то определение необходимо повторить с более разбавленной пробой, т.к. это свидетельствует о недостатке окислителя. Если цвет не изменился, то по истечении указанного времени охлаждают систему, отсоединяют холодильник и приливают в колбу 100 мл дистиллированной воды. Разогревшуюся смесь вновь охлаждают, прибавляют 3-5 капель индикатора и избыток бихромата калия оттитровывают 0,25 н раствором соли Мора до перехода окраски в устойчивый зеленый цвет. Параллельно проводят опыт с 20 мл дистиллированной воды (контроль). поправку титра раствора соли Мора устанавливают по титрованному раствору бихромата калия или перманганата калия (в трех повторностях). В колбу 100 мл вводят пипеткой 10 мл раствора соли Мора, добавляют 1-2 мл концентрированной серной кислоты, 3-4 капли фенилантраниловой кислоты и титруют титрованным раствором перманганата калия (0,1 н) до бледно-розовой окраски.
Бихроматная окисляемость рассчитывается по формуле:
где
Расчет титра соли Мора:
где 0,1 – нормальность раствора 10 – объем раствора соли Мора, мл. Округление результатов производят в зависимости от величины бихроматной окисляемости.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что показывает величина значения ХПК (БПК)? 2. Известные методы определения ХПК и их особенности. 3. Факторы, влияющие на значение величины ХПК, и их учет либо устранение. 4. Что является сильным окислителем для загрязнений воды? 5. Погрешность методов определения окисляемости.
ТЕХНИКА БЕЗОПАСНОСТИ
1. Все работы с кислотами и окислителями выполняются под тягой. 2. Перед сжиганием (кипячением) проб воды с окислителями проверяется исправность работы водяных холодильников. 3. Каждый реактив забирается соответствующей пипеткой. 4. Перед смешением воды и кислот необходимо проверить целостность стеклянной посуды (вливать кислоту в воду, а не наоборот).
ЛАБОРАТОРНАЯ РАБОТА №4
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 393; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |

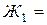







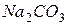 на 20 л) и осветленной (фильтрование через бумажный фильтр);
на 20 л) и осветленной (фильтрование через бумажный фильтр); и рассчитать оптимальное время контактирования воды на фильтрующей установке.
и рассчитать оптимальное время контактирования воды на фильтрующей установке. ) или бихромат калия (
) или бихромат калия (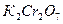 ). Для удобства использования полученных результатов их пересчитывают и представляют в виде количества кислорода эквивалентного израсходованному окислителю. В зависимости от применяемого окислителя различают окисляемость перманганатную, бихроматную и др. Выбор метода определения зависит от количества загрязнений в воде и от их природы (органические или минеральные). Так для анализа питьевой воды и слабо загрязненных поверхностных вод (окисляемость которых не выше 100 мг О2/л) применяют перманганатный метод. Для определения общей окисляемости сильно загрязненных и сточных вод (окисляемость 100 и более мг О2/л) используют бихроматный метод.
). Для удобства использования полученных результатов их пересчитывают и представляют в виде количества кислорода эквивалентного израсходованному окислителю. В зависимости от применяемого окислителя различают окисляемость перманганатную, бихроматную и др. Выбор метода определения зависит от количества загрязнений в воде и от их природы (органические или минеральные). Так для анализа питьевой воды и слабо загрязненных поверхностных вод (окисляемость которых не выше 100 мг О2/л) применяют перманганатный метод. Для определения общей окисляемости сильно загрязненных и сточных вод (окисляемость 100 и более мг О2/л) используют бихроматный метод.
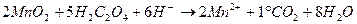
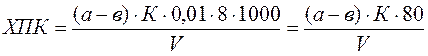 мг О2/л,
мг О2/л, – количество 0,01 н раствора перманганата калия израсходованного на титрование анализируемой пробы, мл;
– количество 0,01 н раствора перманганата калия израсходованного на титрование анализируемой пробы, мл; – количество 0,01 н раствора перманганата калия израсходованного на титрование холостой пробы, мл;
– количество 0,01 н раствора перманганата калия израсходованного на титрование холостой пробы, мл; – поправочный коэффициент для раствора перманганата калия (
– поправочный коэффициент для раствора перманганата калия ( – объем пробы, взятой для анализа, мл.
– объем пробы, взятой для анализа, мл. в 1 л, а от 10 до 100 мг
в 1 л, а от 10 до 100 мг  мг О2/л
мг О2/л ,
, ;
;


