
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Умягчение, обессоливание и обескремнивание водыСодержание книги Поиск на нашем сайте
МЕТОДОМ ИОННОГО ОБМЕНА
Цель работы - изучение отдельных физико-химических свойств воды и методов ее деминерализации (обессоливания и умягчения).
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Вода - самое распространенное минеральное природное соединение на Земле. В естественных условиях вода не встречается в химически чистом состоянии, поскольку, соприкасаясь с воздухом, почвой, осадочными породами, насыщается различными примесями, растворенными и нерастворенными веществами. Растворенные соединения (органические и неорганические) находятся в воде в виде ионов, нерастворенные (так же неорганические и органические) - в виде грубодисперсных примесей (ГДП), а так же в составе коллоидных примесей. Кроме того, в природной воде присутствуют растворенные газы (кислород, азот, углекислый газ и др.) и различные микроорганизмы, животного и растительного происхождения (бактерии, вирусы, водоросли и пр.) Таким образом, природная вода представляет собой сложную динамическую систему, содержащую газы, минеральные и органические вещества, в растворенном, коллоидном или взвешенном состоянии. Основные ионы можно расположить по частоте их присутствия в воде в порядке убывания:
В поверхностных водах часто присутствует также кремниевая кислота
1.1. Физико-химические свойства воды. Понятие – жесткость воды
Все природные воды по преобладающему иону делятся на три группы: гидрокарбонатные ( Вода характеризуется определенной величиной активной реакции среды ( В зависимости от солесодержания природные воды подразделяются на пресные (до 1,0 г/кг); солоноватые (1-10 г/кг) и соленые (более 10 г/кг). Для оценки суммарного солесодержания и органических примесей, содержащихся в воде в истинно растворенном и коллоидном состоянии, используется показатель – сухой остаток. Числовое значение его определяется взвешиванием остатка после выпаривания определенного объема профильтрованной воды и выражается в мг/л. Часть сухого остатка, которая удаляется при последующем прокаливании его, дает ориентировочно представление о содержании в воде органических веществ.
Жесткость воды – один из важнейших показателей качества воды. Жесткость воды обусловлена наличием в ней солей кальция ( Временная (карбонатная или устранимая) Жк связана, в основном, с присутствием растворенных гидрокарбонатов кальция и магния
Постоянная жесткость (некарбонатная жесткость) Жн определяется содержанием в воде хлоридов, сульфатов, нитратов кальция и магния, остающихся и после кипячения в растворенном состоянии. Сумма временной и постоянной жесткости называется общей жесткостью. Единицей измерения жесткости в РБ и странах СНГ является величина, характеризующая концентрацию различных ионов в единицах, которые учитывают их молярную массу и электрический заряд – грамм-эквивалент на литр раствора (г-экв/л). Или частное от деления единицы количества вещества (моля) на величину суммарного электрического заряда созданного ионом (или валентность). При водоподготовке чаще используют более мелкую единицу, чем г-экв/л - миллиграмм-эквивалент в литре (мг-экв/л), составляющей одну тысячную долю грамм-эквивалента (жесткость в 1 мг-экв/л отвечает содержанию 20,04 мг/л В других странах принято обозначать жесткость воды в условных градусах (немецкий, английский и пр. градусы). Вода с жесткостью до 4 мг-экв/л характеризуется как мягкая; от 4 до 8 – средней жесткости, от 8 до 12 – жесткая. Общая жесткость питьевой воды – 7 мг-экв/л, в исключительных случаях допускается 10 мг-экв/л (стандарт на питьевую воду). Для использования воды в производстве, а так же в быту из нее удаляют все примеси, которые могут оказать вредное воздействие на оборудование, качество целевого продукта иди здоровье человека. Этот процесс получил название “ водоподготовка”. Требования, предъявляемые к качеству воды в быту и в производстве различные, поэтому используются различные приемы очистки и их сочетания: механическая, физическая, химическая.
Данная работа предусматривает знакомство с приемами водоподготовки, направленными на умягчение, обессоливание и обескремнивание водопроводной воды.
1.2. Умягчение и обессоливание воды
Артезианская вода, которая используется, в основном, в Республике Беларусь, характеризуется достаточно высокой карбонатной жесткостью, поэтому нуждается в умягчении. Умягчение может проводиться несколькими методами: термическим, химическим и катионным. Перед умягчением воды из нее удаляются взвешенные и коллоидные примеси.
Термический метод При нагревании воды гидрокарбонаты кальция и магния переходят из раствора в трудно растворимые соли -
Химический метод Вода обрабатывается известью, содой (содово-известковый метод), а также серной или соляной кислотой. Растворенные гидрокарбонаты переходят в нерастворимые соединения, которые отделяются, либо переходят в хорошо растворимые соли, не выпадающие в осадок при нагревании воды.
Если при химическом умягчении выпадет осадок, то его отделяют (осветление воды) различными методами (отстаиванием, фильтрованием и пр.).
Ионирование (обессоливание) Умягчение воды катионированием производится путем фильтрования предварительно осветленной воды (освобожденная от взвешенных нерастворимых примесей) через катионообменную смолу (катионит), частицы которой содержат на своей поверхности катионы
Ионообменная смола (катиониты и аниониты) – нерастворимый зернистый материал, способный в водных растворах обменивать содержащиеся в нем подвижные катионы и анионы на катионы и анионы водного раствора. У катионита и анионита есть предельная возможность к обмену своих подвижных ионов ( Восстановление свойств катионита в
Восстановленные и отмытые водой ионитовые фильтры могут быть снова использованы для умягчения воды или для обессоливания. При обессоливании осуществляется удаление как катионов (аналогично удалению ионов кальция и магния), так и анионов Удаление аниона кремниевой кислоты из воды осуществляется при контакте с сильно основным анионитом.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Описание лабораторной установки
Установка (рис 1.1.) включает в себя емкость 1 для воды, поступающей на обессоливание; колонки с ионообменными смолами 2 (катионит) и 3 (анионит); емкость 4 - сборник обессоленной воды; две емкости 6 и 7 для растворов соляной кислоты и щелочи, используемых по мере необходимости, для регенерации ионообменных смол установки. Разряжение в системе создается с помощью водоструйного насоса 5.
Рис 1.1. Лабораторная установка умягчения и обессоливания воды на ионообменных смолах
2.2. Методика проведения работы
Экспериментальная работа состоит из двух частей: 1 – определение жесткости питьевой воды до и после различных методов ее умягчения, 2 – определение эффективности умягчения и обессоливания воды на ионообменных смолах в зависимости от ее расхода.
2.2.1. Определение жесткости воды
Для определения жесткости каждый вид исследуемой воды (см. п. 3) отбирают предварительно в отдельные колбы по 0,5 л. Для анализа к 100 мл пробы воды добавляют 5 мл аммиачного буферного раствора и 9-10 капель индикатора (хрома темносинего или хромогена черного). После этого смесь титруют по 1 капле 0,1 н раствором трилона Б (при интенсивном перемешивании) до изменения окраски (
2.2.2. Определение эффективности умягчения воды на ионообменных смолах
Включают водоструйный насос 5 и открывают кран на выходе из емкости 1. Вода самотеком из емкости 1 поступает в колонку 2 с катионитом, откуда за счет разряжения в системе, создаваемого водоструйным насосом, поступает в колонку 3 с анионитом и затем в емкость 4 для обессоленной воды. Расход воды на установке Устанавливают три расхода воды: максимальный, средний, минимальный. При каждом расходе воды определяют величину жесткости обессоленной воды (в трех повторностях), отбираемой из емкости 4 аналогично п. 2.2.1.
2.3. Обработка результатов эксперимента
Жесткость воды определяют по формуле:
где
Эффективность умягчения на ионообменных смолах определяют как:
где
Результаты оформляют в соответствии с таблицами 1.1. и 1.2.
Таблица 1.1.
|
|||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 538; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.54.199 (0.009 с.) |

 - кальций
- кальций
 - гидрокарбонат
- гидрокарбонат
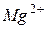 - магний
- магний
 - хлорид
- хлорид
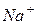 - натрий
- натрий
 - сульфат
- сульфат
 - калий
- калий
 - нитрат
- нитрат
 - аммоний
- аммоний
 - фторид
- фторид
 - железо
- железо
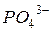 - фосфат
- фосфат
 .
. +
+  ), сульфатные (
), сульфатные ( ). Большинство природных вод имеет величину
). Большинство природных вод имеет величину  ). Различают три вида жесткости: временную, постоянную и общую.
). Различают три вида жесткости: временную, постоянную и общую. и
и  , которые при кипячении переходят в нерастворимые соли (карбонаты кальция и магния) и выпадают в виде плотного осадка (накипи):
, которые при кипячении переходят в нерастворимые соли (карбонаты кальция и магния) и выпадают в виде плотного осадка (накипи):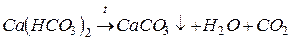

 и
и  , которые выпадают в осадок (уравнения 1 и 2), при этом устраняется временная жесткость воды.
, которые выпадают в осадок (уравнения 1 и 2), при этом устраняется временная жесткость воды.


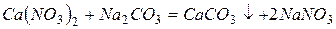
 , способные к обмену на катионы
, способные к обмену на катионы  и
и  солей жесткости, растворенных в воде.
солей жесткости, растворенных в воде.

 - аниониты) на ионы из обрабатываемой воды, после чего необходима их регенерация (восстановление).
- аниониты) на ионы из обрабатываемой воды, после чего необходима их регенерация (восстановление).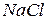 (поваренной соли), либо в
(поваренной соли), либо в  или
или  . Свойства ионообменной смолы анионита восстанавливаются при обработке его 2-4 %
. Свойства ионообменной смолы анионита восстанавливаются при обработке его 2-4 %  .
.

 (в обмен на анион
(в обмен на анион 


 регулируют работой водоструйного насоса и рассчитывают как отношение собранной в емкости 4 воды ко времени сбора. Период сбора воды в емкости контролируют с помощью секундомера.
регулируют работой водоструйного насоса и рассчитывают как отношение собранной в емкости 4 воды ко времени сбора. Период сбора воды в емкости контролируют с помощью секундомера. (мг-экв/л),
(мг-экв/л),
 - нормальность раствора трилона Б;
- нормальность раствора трилона Б; - объем раствора трилона Б, пошедшего на титрование, мл.
- объем раствора трилона Б, пошедшего на титрование, мл. ,
,
 - изменение жесткости воды до и после фильтрования;
- изменение жесткости воды до и после фильтрования; - исходная жесткость воды.
- исходная жесткость воды.


