
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение нитратов в природных и сточных водахСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы: ознакомление с фотометрическим методом определения нитратов в питьевой, сточной и других видах вод.
1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
1.1. Общие сведения и характеристика метода определения нитратов в водных растворах Нитраты – соли азотной кислоты, например NaNO3,KNO3, NH4NO3, Mg(NO3)2. Они являются нормальными продуктами обмена азотистых веществ любого живого организма – растительного и животного, поэтому «безнитратных» продуктов в природе не бывает.
Нитраты встречаются почти во всех видах вод. Большое количество нитратов в поверхностных и подземных водах указывает иногда на загрязнение в прошлом фекальными водами. Значительные количества нитратов содержат некоторые промышленные сточные воды. При современной технологии внесения удобрений в почву растения усваивают только 50 % их, остальные уходят со стоком. Азот поступает в почву в нескольких формах. Нитратная форма вследствие подвижности легко вымывается из почвы. Вода с повышенным содержанием нитратов - потенциальная опасность для здоровья животных и человека. Для воды питьевой (ГОСТ 2874-82) содержание нитратов (NO3) должно составлять не более 45 мг/л. Предельно допустимая концентрация (ПДК) нитратов (по азоту) в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования составляет (по ЛПВ) ~ 10мг/л. В производственных сточных водах, а также сельскохозяйственных водах (стоки от животноводческих ферм) содержание нитратов может достигать до 1000 мг/л. Такая сточная вода должна подвергаться очистке на сооружениях перед ее сбросом в поверхностный водоем или повторном использовании в производстве. Внесение больших доз нитратов при несбалансированности по фосфору, калию, молибдену и др. приводит к накоплению нитратов в растениях. Определение нитратов в грунтовых водах может служить оценкой характера процессов минерализации при фильтровании воды через почвенные соли. При исследовании поверхностных вод по содержанию нитратов можно судить о протекающих процессах самоочищения, а при биологической очистке сточных вод – о процессе нитрификации. Содержание нитратов в растениях выше 0,5 % представляет потенциальную опасность отравления животных. В кишечнике нитраты способны под действием бактерий переходить в нитриты, которые характеризуются значительной токсичностью. Они способны соединяться с гемоглобином крови вместо кислорода, переводя его в метгемоглобин, препятствующего переносу кислорода кровеносной системой. Это заболевание называется метгемоглобинемией. Поэтому для профилактики загрязнения окружающей среды, особенно в районах высоких норм применения азотных удобрений, необходимо наблюдение за составом грунтовых и поверхностных вод и содержанием в них нитратов. Вода, забираемая в водопроводную сеть в качестве питьевой, а также для нужд производства, контролируется на содержание нитратов. В производстве вода, используемая в водооборотных системах, также должна контролироваться на содержание нитратов. Их высокая концентрация может спровоцировать рост водорослей и микроорганизмов в трубопроводах (застойные зоны) и вторичное загрязнение циркулируемой воды в системе продуктами их жизнедеятельности и, соответственно, инициировать процессы биохимической коррозии. Кроме того, биообрастание внутри систем теплообмена снижает теплопередачу и эффективность их работы. Разработано и применяется несколько способов определения нитратов в воде. Выбор метода зависит от концентрации нитратов и цели исследования. Хорошие результаты даёт фотометрический метод с применением химического реагента - салицилата натрия. Интервал определяемых концентраций нитратов - 0,1-20 мг/л. Это определение основано на реакции взаимодействия нитратов с салицилатом натрия в среде концентрированной серной кислоты. При этом образуется смесь 3-нитросалициловой и 5-нитросалициловой кислот, соли которых в щелочной среде имеют жёлтую окраску. Фотометрирование желтоокрашенных растворов проводят при длине волны
1.2. Фотометрический метод анализа
Фотоколориметрический метод анализа основан на измерении интенсивности светового потока, прошедшего через окрашенный раствор (предложен русским ученым В.М. Севергиным, 1795 г.). Сущность анализа заключается в переводе различных исследуемых соединений (в составе газов, воды и почвы) в раствор с последующим их окрашиванием. Через окрашенный раствор пропускают световой поток и по светопоглощению такого окрашенного раствора определяют содержание окрашенного исследуемого соединения в анализируемом растворе. Зависимость между интенсивностью окрашивания раствора и содержанием в нем окрашенного соединения может быть выражена зависимостью
Если прологарифмировать уравнение (1) и изменить знаки на обратные, то уравнение примет вид:
Прибор для фотоколориметрии – ФЭК (фотоэлектроколориметр). В состав прибора КФК-2 входятLоптическая система) - источник света, светофильтры, линзы, фотоэлемент, преобразователь светового потока в электросигнал на гальванометре, гальванометр, кюветодержатель, ручки (чувствительность и длина волны), набор кювет для растворов.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Устройство и принцип работы фотоэлектроколориметра (КФК-2) КФК-2 является однолучевым прибором и предназначен для измерения коэффициентов пропускания (в диапазоне длин волн 315-980 нм) и абсорбционности растворов. Пределы измерения коэффициентов пропускания от 100 до 5 %. На рис. 1 приведена оптическая схема КФК-2.
Рис. 1 Оптическая схема КФК-2
1 - лампа накаливания; 2 - конденсоры; 3 - диафрагма; 4,5 - объективы; 6,7,8 – светофильтры;
Колориметр включают в сеть за 15 минут до начала измерений (кюветное отделение открыто). Кюветы установленного размера подготавливают к работе следующим образом: рабочие поверхности кювет протирают обезжиривающей смесью. После каждого определения на приборе, кюветы промывают от рабочей смеси дистиллированной водой не менее трех раз и тщательно протирают фильтровальной бумагой. В приборе КФК используют для измерения две кюветы. Одна – с «холостой» пробой и вторая – для анализа исследуемой пробы. Измерение оптической плотности начинают с «холостой» пробы (Д1), после нее измеряют оптическую плотность окрашенного исследуемого раствора (Д2). Разница между показаниями фиксируется в виде показателя Д – светопропускания. Данная величина будет расти по мере увеличения разницы концентраций «холостой» и контрольной пробами. Графическая зависимость оптической плотности (светопропускания) Д от концентрации анализируемого соединения называется калибровочным графиком. На нем принято указывать дату калибрования на приборе, чувствительность, светофильтр, размер кюветы для раствора. На приборе левой ручкой устанавливают заданную измерением длину волны (светофильтр), а верхней правой - минимальную чувствительность прибора. В кюветодержатель прибора вставляют кювету с «холостой» пробой (дистиллированная вода + реактивы для определения анализируемого вещества), закрывают крышку кюветного отделения и ручками «чувствительность», «установка 100», «грубо» и «точно» устанавливают ноль по шкале абсорбционности (Д – оптическая плотность). Поворотом ручки кюветодержателя (снизу) кювету с «холостой» пробой заменяют на кювету с рабочим окрашенным раствором. Снимают отсчет по шкале микроамперметра. Измерения одной пробы проводят не менее 3-х раз и окончательное значение измеренной абсорбционности определяют как среднее арифметическое из полученных значений.
2.2. Методика проведения работы
2.2.1. Построение калибровочного графика. Используя рабочий раствор нитрата калия, согласно таблице 1 готовят серию стандартных растворов, содержащих NO3. Рабочий раствор KNO3 содержит 10 мг/л Таблица 1 Растворы для приготовления шкалы стандартов при определении нитратов в воде
В фарфоровые чашки отбирают пробы по 20 мл с различным содержанием NO3, добавляют по 2 мл салицилата натрия и выпаривают на песчаной бане досуха. Затем охлаждают чашки с осадком, добавляют в них по 2 мл концентрированной серной кислоты и оставляют на 10 минут. По истечении этого времени в чашки приливают 15 мл дистиллированной воды, 15 мл раствора едкого натра и сегнетовой соли. Внимание!!! Реагенты приливать в указанном порядке! Далее полученную смесь количественно переносят в мерные колбы ёмкостью 50 мл, обмывая стенки чашек дистиллированной водой, колбы охлаждают до комнатной температуры. После охлаждения доводят объём дистиллированной водой до метки и измеряют оптическую плотность растворов при длине 410 нм (фиолетовый фильтр) в кюветах толщиной слоя 5 см. Измерение нужно проводить не позднее, чем через 10 мин. после приливания гидрооксида натрия, в противном случае окраска раствора изменяется. Для построения калибровочного графика можно сократить количество замеров (колб с пробами) до 4-5 штук. Калибровочный график строят в координатах: оптическая плотность Д – концентрация нитрат-ионов
2.2.2. Определение нитратов в пробах воды
Проводят анализ проб воды различных источников (по заданию преподавателя). Перед началом работы необходимо внимательно осмотреть пробу. Если очевидно, что в ней присутствуют окрашенные органические соединения, необходимо отобрать 150 мл пробы, прибавить к ней 3 мл суспензии гидроксида алюминия. После тщательного перемешивания пробу воды отстаивают, затем фильтруют, отбрасывая первые порции фильтрата. Затем отбирают 20 мл фильтрата и анализируют пробу как указано выше (см. п. 2.2.1.). Параллельно проводят холостую пробу с 20 мл дистиллированной воды. Результаты анализов заносят в таблицу 2.
2.3. Обработка результатов эксперимента
Обработка результатов измерений ведется МНК с использованием ПЭВМ и представляется в графическом виде (см. рисунок 1) с указанием ошибки в определении ( По полученным данным строится график зависимости оптической плотности Д от концентрации нитратов в пробах (шкала стандартов). На графике приводят данные по условиям анализа (номер светофильтра, толщина кюветы, чувствительность и дату выполнения калибровочного графика).
Рис.2. Калибровочный график
По оптической плотности анализируемых проб воды на калибровочном графике находят содержание нитратов в растворе. По найденным значениям рассчитывают содержание нитрат-ионов в исследуемых пробах (мг/л):
где С – концентрация нитрат-ионов, найденная по калибровочной кривой, мг/л; V – объём пробы, взятой для анализа, мл. Результаты анализа и расчета концентрации нитратов в пробах воды приводят в таблицу 2. Таблица 2 Результаты анализа воды различного происхождения
3. ЗАДАНИЕ
1. Построить калибровочный график. 2. Провести анализ проб воды различных источников (по заданию преподавателя). 3. На основании результатов анализа сделать вывод о качестве воды и ее пригодности для целевого использования (питьевое снабжение, водооборотная система производства, сброс в поверхностный водоем).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Опасно ли использовать воду как питьевую, если в ней содержание нитратов 35 мг/л? 2. Устройство и принцип работы фотоэлектроколориметра. 3. Теоретические основы колориметрии. 4. Принцип построения калибровочного графика. Точность определения анализируемого компонента. 5. С каким содержанием нитратов (после сооружений очистки сточных вод) можно сбрасывать очищенную сточную воду в поверхностный водоем? 6. Почему вводят ограничения на содержание в воде нитратов?
ТЕХНИКА БЕЗОПАСНОСТИ
1. Перед работой ознакомиться с устройством и принципом работы фотоэлектроколориметра (КФК). 2. Всю работу с фарфоровыми чашками проводить только в вытяжном шкафу при включенной тяге. 3. С реактивами работать в резиновых перчатках. 4. Отбор серной кислоты проводить под тягой с помощью пипетки. 5. Реагенты приливать в строго указанном порядке. 6. По окончании работы вымыть руки с мылом.
ЛАБОРАТОРНАЯ РАБОТА № 6 ОПРЕДЕЛЕНИЕ ФОСФАТОВ В ПРИРОДНОЙ И СТОЧНОЙ ВОДЕ 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
В сточных водах, как и в природных водах, фосфор может присутствовать в различных видах. В жидкой фазе анализируемой воды он может быть в виде ортофосфорной кислоты и её ионов ( При взаимодействии ортофосфат-ионов с молибдатом в кислой среде образуется жёлтая гетерополикислота, которая под действием восстановителей превращается в интенсивно окрашенное синее соединение. Восстановление можно проводить оловом или аскорбиновой кислотой. Восстановление аскорбиновой кислотой, сравнительно слабым восстановителем, происходит только при повышенной температуре, т.е. в условиях, когда полифосфат и органические эфиры фосфорной кислоты гидролизуются с образованием ортофосфорной кислоты. Для ускорения реакции при комнатной температуре и интенсификации окраски вводят соль сурьмы (антимонилтартрат калия – КSbH4O6·0,5H2O).
Мешающие вещества. Сильнокислые и сильнощелочные пробы предварительно нейтрализуют. Определению мешают сульфиды и Н2S, в концентрации, превышающих 3 мг/л. Мешающие влиянию можно устранить, прибавляя несколько мг КMnО4 на 100 мл пробы и встряхивая 1-2 мин; раствор должен быть розовым. Затем прибавляют требуемые для определения реактивы, но в обратном порядке: сначала раствор аскорбиновой кислоты, перемешивают и вливают раствор молибтана. Для устранения влияния нитритов вводят сульфаминовой кислоты, которую вводят в состав применяемого реактива. При большом содержании железа следует ввести эквивалентное количество ЭДТА.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Концентрацию фосфатов определяем в питьевой и сточной воде. К 50 мл пробы, профильтрованной в день отбора через мембранный фильтр № 1 или через плотный бумажный фильтр (синяя лента), приливают 2 мл смешанного раствора через короткое время – 0,5 мл раствора аскорбиновой кислоты (в присутствии мешающих веществ, реактивы приливают в обратном порядке). Смесь перемешивают. Одновременно проводят холостое определение с 50 мл дистиллированной воды. Через 15 мин (20 мин.) определяют оптическую плотность. Измерение проводят при
Расчёт. Содержание растворённых неорганических фосфатов (мг/л) ( Х = С×1000/V,
где С – концентрация фосфатов, определённая по калибровочной кривой, мг/л; V – объём пробы, взятой для анализа, мл. В диапазоне концентраций до 1 мг/л результаты округляют до сотых долей мг/л, свыше 1 мг/л – до десятых долей мг/л.
Построение калибровочного графика
Берут 0; 1,0; 2,5; 5,0…..50,0 мл рабочего стандартного раствора 2 фосфата калия, разбавляют каждый раствор до 50 мл дистиллированной Н2О и далее продолжают, как в ходе определения (общее содержание растворённых ортофосфатов, найденных экспериментально, выражают в мг/л Измеряют оптическую плотность и строят график зависимости оптической плотности от концентрации ионов фосфорной кислоты. Таблица 1. Построение калибровочной кривой.
3. ЗАДАНИЕ
1. Построить калибровочную кривую в диапазоне 0-1 мг/л 2. Провести определение фосфата в водопроводной воде (сравнить данные с ГОСТ на воду питьевую). 3. Рассчитать и построить калибровочную кривую на содержание фосфатов до 50 мг/л. 4. Провести определение содержание ПРИЛОЖЕНИЕ Таблица 1 Давление насыщенного водяного пара при температурах от 10 до 39 °С
Таблица 2 Плотность элементов
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 2177; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.33 (0.012 с.) |

 = 410 нм.При необходимости мешающее влияние окрашенных органических веществ устраняют предварительной обработкой пробы суспензией гидроксида алюминия и ее последующего осветления (фильтрования).
= 410 нм.При необходимости мешающее влияние окрашенных органических веществ устраняют предварительной обработкой пробы суспензией гидроксида алюминия и ее последующего осветления (фильтрования).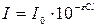 (закон Бугера-Ламберта-Бера), где,
(закон Бугера-Ламберта-Бера), где,
 - интенсивность света, прошедшего через окрашенный раствор;
- интенсивность света, прошедшего через окрашенный раствор; 
 - интенсивность падающего света;
- интенсивность падающего света; - коэффициент поглощения света (зависит от природы окрашенного вещества);
- коэффициент поглощения света (зависит от природы окрашенного вещества);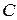 - концентрация окрашенного вещества в растворе;
- концентрация окрашенного вещества в растворе; - толщина слоя светопоглощающего раствора, см.
- толщина слоя светопоглощающего раствора, см.
 - называют оптической плотностью (Д) раствора, которая прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
- называют оптической плотностью (Д) раствора, которая прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
 9,11 – защитные стекла; 10 – кювета с раствором; 12 – фотодиод; 13 – светофильтр; 14 – делительная пластина;15 – фотоэлемент.
9,11 – защитные стекла; 10 – кювета с раствором; 12 – фотодиод; 13 – светофильтр; 14 – делительная пластина;15 – фотоэлемент. . Для этого в мерные колбы на 50 мл вносят определенное количество рабочего раствора и доводят дистиллированной водой до метки.
. Для этого в мерные колбы на 50 мл вносят определенное количество рабочего раствора и доводят дистиллированной водой до метки. , мг/л
, мг/л
 (
(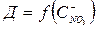 )
) ).
).
 ,
,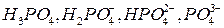 ), в виде мета-, пиро- и полифосфатов органических соединений (нуклеиновых кислот, нуклеопротеиды, фосфоролипиды и др.)
), в виде мета-, пиро- и полифосфатов органических соединений (нуклеиновых кислот, нуклеопротеиды, фосфоролипиды и др.) ) определяют по формуле:
) определяют по формуле: (табл.1).
(табл.1). , °C
, °C
 , мм.рт.ст.
, мм.рт.ст.



