
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение содержания анионов в поверхностных водахСодержание книги
Поиск на нашем сайте
В поверхностных водах, кроме анионов HCO3-, СО32-, OН-, которые определялись в предыдущих работах, содержится ряд других анионов (SO42-, Cl-, HSiO3-, NO3-, PO43- и др.). Сульфат-ионы поступают в природные воды в результате растворения гипсовых пород, мирабилита, окисления сульфидов, органических серо-содержащих веществ. Содержание сульфат-ионов может быть достаточно высоким в водах атмосферных осадков вследствие загрязнения воздуха промышленными выбросами. Предельное содержание сульфат-ионов в воде источника централизованного водоснабжения – до 500 мг/л. Хлориды по общему содержанию в природных водах занимают первое место среди анионов. Они появляются в природных водах при растворении горных пород, содержащих хлориды, выбрасываются в большом количестве при извержении вулканов, являются постоянным компонентом стоков многих предприятий. Содержание их колеблется от десятых долей до тысячи мг/л. Однако в воде рек концентрация хлоридов невелика – она превышает обычно 10-30 мг/л, поэтому повышенное количество хлоридов указывает на загрязнение источника сточными водами. Концентрация хлорид-ионов не должна превышать для питьевой воды 350 мг/л. Лимитирование верхнего предела концентраций SO42- и Cl- обусловлено тем, что более высокие концентрации этих ионов придают воде солоноватый вкус и могут вызвать нарушение в работе желудочно-кишечного тракта у людей. При некоторых соотношениях SO42- и Cl- вода становится агрессивной по отношению к некоторым типам бетона. В природных водах кремниевая кислота может находиться в формах метакремниевой H2SiO3 (H2О·SiO2), ортокремниевой H4SiO4 (SiO2·2H2О) и поликремниевой H2SiO5 (2SiO2·H2О) кислот. Все эти кислоты при обычных для природных вод значениях рН малорастворимы и образуют в воде коллоидные растворы. Силикаты – нежелательная примесь в воде, питающей котлы, так как дает силикатную накипь на стенках котлов. Нитраты могут появляться в воде при разложении органических остатков, поступать с атмосферными осадками или стоками, содержащими органические вещества. Содержание их в чистых водоемах оценивается десятыми и сотыми долями мг/л. Допустимое содержание нитратов (по NO3-) в воде питьевого назначения – 45 мг/л. Присутствие ряда анионов в воде является необходимым для питания растений, нормальной жизнедеятельности плавающих форм живых организмов. Однако избыток анионов может угнетать живые организмы. Избыток нитрат- и фосфат-ионов может привести к эвтрофикации водоемов. Содержание фосфатов в поверхностных водах обычно невелико – сотые и тысячные доли мг/л. Допустимое содержание в питьевой воде – 3,5 мг/л. Под эвтрофикацией вод понимают обогащение их биогенными элементами (азотом, фосфором, углеродом или веществами, их содержащими); следствие эвтрофикации – интенсивный рост водорослей и других растений, накопление в водоемах органических веществ и других продуктов отмирания организмов. Это создает условия дляувеличения численности организмов-редуцентов, питающихся мертвым органическим веществом и разлагающих его до исходных минеральных элементов и СО2. Редуценты в процессе жизнедеятельности интенсивно поглощают кислород. Конечный результат явлений – обескислороживание водной среды и замена аэробных (с участием кислорода) процессов на анаэробные, протекающие в бескислородной среде. Результат анаэробных процессов – выделение в среду сероводорода, метана и других ядовитых загрязняющих веществ. Таким образом, обогащение вод необходимыми для жизни химическими элементами вызывает вторичный крайне отрицательный экологический и санитарно-гигиенический эффект. Явление вызывается природными и антропогенными факторами. Различия в их действии связаны не только с интенсивностью, но и с механизмом отдельных процессов. При эвтрофикации развиваются сине-зеленые водоросли, многие из которых ядовиты. Выделяемые ими вещества относятся к группе фосфор- и серосодержащих органических соединений (нервнопаралитических ядов). Природная эвтрофикация прoтекает как правило, медленно и зависит от минералогического состава пород и грунтов, окружающих водоемы. Водоемы с большими запасами воды и расположенные среди кристаллических пород мало подвержены эвтрофикации. Они в течение тысячелетий могут оставаться в олиготрофиом (бедном питательными веществами) состоянии. Пример такого водоема – озеро Байкал. Медленная эвтрофикация характерна также для озер ледникового происхождения. Это основные резервуары озерной чистой воды. Такие водоемы вместе с тем в силу малой насыщенности жизнью и низких температур имеют слабую способность к самоочищению. Поэтому они весьма чувствительно реагируют на загрязнения. Антропогенной эвтрофикации в настоящее время подвержены практически все внутренние водоемы и некоторые моря. Факторами ее являются минеральные удобрения, а в ряде случаев моющие средства, компоненты которых – поверхностно-активные вещества (ПАВ), изготавливаемые на фосфорной основе. Источниками эвтрофикации вод являются также бытовые и промышленные стоки, животноводческие комплексы, подогретые воды, рекреационные воздействия, преобразования текущих вод в стоячие и другие результаты человеческой деятельности.
Цель работы: Определить содержание основных анионов в природной воде, дать характеристику исследуемой воде, указать возможные пути и последствия от поступления анионов в данный водоем. Оборудование: нитратомер ЭКО-01, нитратоселективный и хлорсеребряный электроды, пенал для определения фосфатного числа, бюретки для титрования, оловянная палочка. Реактивы: 0,028 нраствор нитрата серебра, раствор хромовокислого калия, раствор сульфомолибдата аммония, раствор KNO3 − 0,1 н. Порядок выполнения работы Определение хлорид-ионов Метод основан на титрометрическом осаждении хлоридов в нейтральной среде или слабощелочной среде нитратом серебра в присутствии бихромата калия в качестве индикатора. В пробу воды объемом 100 мл добавляют 10 капель раствора хромово-кислого калия, хорошо перемешивают и оттитровывают раствором азотнонокислого серебра. Раствор титранта добавляют до тех пор, пока в воде не появится устойчивый бурый оттенок, свидетельствующий об образовании хромата серебра. Содержание хлорид-ионов в пробе воды составит, мг/л:
где V1 – объем раствора нитрата серебра, пошедшего на титрование, мл; N1 – нормальность раствора нитрата серебра; Э – миллиграм-эквивалент хлора; V2 – объем исследуемой воды. Определение фосфатов Сущность заключается в том, что сульфомолибдатный раствор, введенный в испытуемую пробу воды в присутствии погруженной с нее оловянной палочки, реагирует с фосфатами, в результате чего вода окрашивается в синий цвет, интенсивность которого тем больше, чем выше концентрация фосфатов в воде. В мерную пробирку наливают 2 мл отфильтрованной пробы воды, доводят объем жидкости сульфомолибдатным раствором до 10 мл. Затем в раствор опускают очищенную наждачной бумагой и ополоснутую дистиллированной водой оловянную палочку. Через 5 мин (за это время раствор в пробирке вместе с оловянной палочкой должен быть 2...3 раза перемешен легким встряхиванием) оловянную палочку вместе с пробкой вынимают из пробирки и сравнивают окраску испытуемого раствора с окраской стандартной цветной шкалы. Для этого пенал, в котором находится штативчик с фосфатной шкалой, снимают с задней стенки лабораторного ящика, вынимают штативчик и в него вставляют (через верхнее отверстие) мерную пробирку так, чтобы она оказалась в специальном гнезде на фоне молочного стекла рядом с ячейками цветной шкалы. Позади штативчика должен находиться источник света расположенный так, чтобы окраска исследуемого раствора сравнивалась с окраской штатной шкалы в рассеянном проходящем свете. Фосфатное число воды соответствует цифре, стоящей против ячейки шкалы, окраска которой совпадает с окраской раствора в пробирке или наиболее близка к ней. Результаты определения выражены в виде концентраций фосфат ионов PO43- (мг/л). Фосфатную шкалу следует хранить в футляре. Она должна быть на свету только во время колориметрирования. Определение нитратов Определение нитратов проводят с помощью нитратомера, используя ионоселективный электрод. Предварительной частью работы является подготовка нитратомера. Сначала электроды готовят к работе. Для этого внутрь хлорсеребряного электрода (вспомогательного) заливают насыщенный раствор KCl и выдерживают сутки в стакане с насыщенным раствором. Между испытаниями такой электрод хранят в дистиллированной воде. Ионоселективный электрод ЭМ-NO3-01 заполняют после промывки при-электродным раствором, который содержит 10,11 г KNO3 и 0,37 г KCl на 1 л раствора. Выдерживают в растворе KNO3 с концентрацией 10-1 моль/л в течение суток. Приготовленные таким образом электроды готовы к работе. Их подключают в соответствующие гнезда прибора и производят калибровку системы. Для этого электроды сначала погружают в 10-4 М раствор KNO3 и включают прибор нажатием кнопки "вкл". Затем нажимают кнопку "изм". ВНИМАНИЕ! Эту кнопку можно нажимать только в том случае, если электроды погружены в раствор. С помощью регулировки ручек выставляется "0" на шкале прибора. Отжать кнопку "изм" и перенести электроды, предварительно вымыв в дистилляте и высушив фильтровальной бумагой, в стандартный раствор с концентрацией 10-3 М KNO3. Нажать кнопку "изм" и ручкой "крутизна" выставить значение 56 мВ (при нажатой кнопке "диап" шкала прибора соответствует 100 мВ, при отжатой – 200 мВ). Для проверки правильности калибровки перенести электроды в 10-2 М раствор KNO3. Показания прибора должны соответствовать 112 мВ. Если показания не соответствуют 112 мВ, произвести повторную настройку прибора по растворам. Непосредственные измерения заключаются в следующее. В пробу воды помещают электроды, включают прибор и через 1...2 мин снимают показания прибора. Сравнивая показания прибора с данными настройки, рассчитывают содержание нитрат-ионов в исследуемой пробе. Требования к отчету В отчете приводится описание хода выполнения работы, результаты расчета содержания анионов. Сделать предположение о характере подстилающих пород и поступающих стоков. Выявить последствия для водной экосистемы от избыточного поступления анионов.
Лабораторная работа № 7
|
||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 889; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

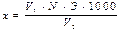 ,
,


