
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение окисляемости природных водСодержание книги
Поиск на нашем сайте
Окислительно-восстановительные процессы в природных водах представляют собой главным образом превращение органических соединений. Одним из непременных условий существования водных экосистем являются процессы разложения органических соединений, в результате которых идет окисление соединений до углекислого газа, воды и различных соединений азота, фосфора, серы. Пока имеется в воде свободный кислород окисление идет, как правило, до оксидов элементов в высшей степени окисления. Этот общий процесс окисления для целлюлозы можно представить в виде схемы: (C6H10O5)n + 1/2n H2O целлюлоза целлобиоза
Образующаяся в результате ферментативного гидролиза глюкоза превращается в пировиноградную кислоту и вступает в цикл трикарбоновых кислот (цикл Креббса), превращаясь в конечном итоге в СО2 и Н2О: C6H12O6 + 6O2à 6СО2 + H2O Жиры в аэробных условиях гидролизуются с образованием глицерина (многоатомного спирта) и карбоновых кислот
О СН2 – ОС – R1 СН2 – ОН R1 – СООН СН – ОС – R2 + 3 Н2О → СН – ОН + R2 – СООН СН2 – OC – R3 СН2 – ОН R3 – СООН O Образующийся спирт (глицерин) легко окисляется до СО2 и Н2О.
СН2 – ОН 2 СН – ОН + 7О2 → 6 СО2 + 8Н2О СН2 – ОН
Высшие карбоновые кислоты окисляются гораздо медленнее, но также превращаются в СО2 и Н2О. С17Н35СООН + 26 О2 → 18 СО2 + 18Н2О
Для различных алканов можно представить следующую схему превращений в аэробных условиях:
Белковые соединения в результате гидролиза разлагаются до аминокислот. Аминокислоты подвергаются дезаминированию
NH2 O Образовавшиеся кетокислоты окисляются до СО2 и Н2О, а аммиак в результате дальнейшего окисления превращается в нитриты, а затем в нитраты: 2NH3 + 3O2 à 2HNO2 + 2H2O 2HNO2 + O2 à 2HNO3 2HNO3 + Ca (HCO3)2 à Ca (NO3)2 +2CO2 +2H2O Все процессы идут, как правило, под действием микроорганизмов, группы которых последовательно сменяют друг друга после завершения своей стадии превращения органических соединений. В анаэробных условиях (при недостатке или отсутствии кислорода в воде) окислительно-восстановительные процессы идут несколько иначе. Микроорганизмы для окисления органических соединений используют кислород нитратов, сульфатов и других соединений. В виде общей схемы процесс можно представить так: COP2 + 2NO3- + 2H+à N2 + 2,5CO2 + H2O COP2 + SO42- + 2H2Oà H2S + 2 HCO3 Разложение органических веществ в анаэробных условиях – это, прежде всего, брожение, в качестве примеров которого можно показать следующие: C6H12O6 à CH3-CH2-COOH + CH3COOH + CO2 +H2 масляно-кислое CH3-CH2-COOH + CO2 + 2H2O à CH4 + CO2 метановое CH3COOH à CO2 + CH4 Разумеется, процессы окисления органических соединений много сложнее и разнообразнее, здесь приведены лишь некоторые схемы. Одной из характеристик природных вод может служить их окисляемость – это количество кислорода, потребляемое на окисление органических и неорганических соединений. Другое определение окисляемости – это количество веществ-восстановителей, содержащихся в 1 л воды и реагирующих с сильными окислителями. Химическую окисляемость определяют с использованием в качестве окислителей бихромата калия К2Сr2О7 (бихроматная окисляемость), иодата калия КIO3 (иодатная окисляемость) КMnО4 (перманганатная окисляемость). Бихроматную и иодатную окисляемость иначе называют химической потребностью в кислороде, или ХПК. Это название точно отражает сущность определения окисляемости, так как оценивается количество кислорода, необходимое для окисления примесей воды, т. е. для перевода С в СО2, H в Н2О, N в NH3, Р в фосфаты, S в сульфаты и т. д. Различают ХПК теоретическую, вычисляемую по стехиометрическому уравнению окисления (для чего должен быть известен химический состав примесей), и экспериментальную, определяемую с использованием бихромата или йодата калия. Экспериментальная ХПК часто меньше теоретической, поскольку ряд органических веществ (красители, СПАВ, сложные углеводороды и др.) либо вовсе не окисляются бихроматом и иодатом в условиях определения, либо окисляются не до конца. Степень окисления органических и неорганических веществ можно узнать в течение времени, отбирая пробы и определяя окисляемость через промежутки времени. Однако такой способ недостаточно точно позволяет смоделировать процессы в водоемах. Гораздо ближе отражает естественные процессы определение количества кислорода, потребляемого микроорганизмами в аэробных условиях. Такой показатель называют БПК − биохимический показатель кислорода. Для водоемов с хорошо сбалансированной экосистемой эти показатели отличаются незначительно (на величину органических веществ, идущих на построение клеток тела микроорганизмов). Для водоемов, загрязненных незначительно биологическими отходами антропогенного характера, величина перманганатной или бихроматной окисляемости гораздо выше, чем БПК. Биохимическая окисляемостьопределяет содержание в воде органических примесей, которые могут быть окислены биохимическим путем. Окисление осуществляют аэробные гетеротрофные бактерии. Значительное число бактерий – облигатных аэробов и факультативных анаэробов способно существовать за счет использования загрязнений (примесей) воды в качестве источника питания. При этом часть использованных органических веществ расходуется на энергетические нужды, а другая часть – на синтез тела клетки. Часть вещества, расходуемая на энергетические потребности, окисляется клеткой до конца, т. е. до СО2, H2O, NH3. Продукты окисления – метаболиты – выводятся из клетки во внешнюю среду. Реакции синтеза клеточного вещества идут также с участием кислорода. Количество кислорода, требуемого микроорганизмам на весь цикл реакции синтеза и получения энергии, и есть БПК. В результате жизнедеятельности бактерий сточная вода очищается от исходных органических примесей, однако в ней остаются некоторые органические вещества, малодоступные или совсем недоступные бактериям для усвоения, и, кроме того, вода получает новые загрязнения – органические и неорганические – метаболиты. Цель работы: познакомиться с процессами окисления органических компонентов природных вод, методами определения окисляемости природных вод. Реактивы: серная кислота плотностью 1,84 г/см3; N – фенилантраниловая кислота (0,25 г кислоты растворяют в 12 мл 0,1 н. раствора NaOH и разбавляют водой до 250 мл); бихромат калия 0,25 н. стандартный раствор; соль Мора 0,25 н. раствор (титр раствора соли Мора предварительно устанавливают по стандартному раствору бихромата калия); сульфат ртути кристаллический. Порядок выполнения работы Отбирают 5 мл пробы, в пробу вводят 2,5 мл 0,25 н. раствора бихромата калия, затем 0,2 сульфата ртути (II) и при перемешивании 7,5 мл концентрированной серной кислоты. При этом температура раствора поднимается выше 100 °С. Через 2 мин. охлаждают раствор до комнатной температуры, приливают 100 мл дистиллированной воды и титруют избыток бихромата. Для этого вводят 10-15 капель раствора N - фенилантраниловой кислоты и оттитровывают раствором соли Мора. Проводят холостой опыт. Для этого берут 5 мл дистиллированной воды и проводят то же операции. Определяют число миллиграммов О2 на 1 л воды:
где b – объем раствора соли Мора, пошедшего на титрование холостой пробы; a – объем раствора соли Мора, пошедшего на титрование пробы; N – нормальность соли Мора; V – объем анализируемой пробы; 8 – эквивалент кислорода. Из оставшейся пробы берут несколько аликвотных частей по 10 мл и вливают в колбы на 50 мл в каждую. Оставляют на несколько дней хранения (по указанию преподавателя) при t = 20°С, плотно закрыв колбы притертой крышкой или пробкой. По истечении указанного времени вновь определяют количество кислорода, пошедшего на окисление, по приведенной выше методике. Повторяют анализ многократно в течение нескольких сроков хранения. Склянки с такой емкостью и содержанием пробы всего 10 мл содержат достаточное количество кислорода, который потребляется для биологического окисления, содержащихся в пробе органических соединений. Разность между количеством кислорода, поведшим на химическое окисление в начальный период и через заданные промежутки времени, показывает то количество кислорода, которое использовали микроорганизмы на окисление соединений, содержащихся в воде. Требования к отчету В отчете приводят название и цель работы, результаты расчета потребленного кислорода, график О(мг) = f (t сут), делают предположение о биологической продуктивности водоема, интенсивности естественных окислительных процессов с использованием данных Приложения 3 и 4.
Вопросы для самоподготовки 1. Особенности воды как растворителя, структура водных растворов. 2. Аномальные свойства вода. 3. Ионное произведение воды. Водородный показатель. 4. Буферные системы, механизм действия буферных систем. 5. Кислотность. Виды кислотности. 6. Щелочность. Виды щелочности. 7. Жесткость воды. Виды жесткости. Способы определения общей, карбонатной и некарбонатной жесткости воды. 8. Способы умягчения воды при водоподготовке. 9. Последствия потребления жесткой воды для живых организмов. 10. Последствия использования жесткой воды в паросиловом хозяйстве. 11. Виды природных вод и особенности их состава. 12. Карбонатная система природных вод, ее связь с рН среды. 13. Растворимость карбонатных пород и ее влияние на рН среды. 14. Окислительно-восстановительный потенциал природных вод. 15. Процессы окислительного разложения целлюлозы. 16. Окисление жиров в гидросфере. 17. Процессы разложения белков в гидросфере. 18. Процессы нитрификации и денитрификации. 19. Пути образования метана и сероводорода в анаэробных условиях. 20. Термическая и химическая стратификация природных водоемов. 21. Причины и пути эвтрофикации водоемов.
III. ХИМИЯ ЛИТОСФЕРЫ
Лабораторная работа № 8
|
||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 708; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |

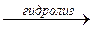 1/2 n C12H22O11
1/2 n C12H22O11
 1/2 C12H22O11 + 1/2n H2O
1/2 C12H22O11 + 1/2n H2O 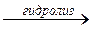 n C6H12O6
n C6H12O6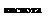
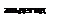
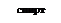 R-CH3
R-CH3 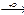 R-CH2OH
R-CH2OH 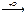 R-CHO
R-CHO  R-COOH
R-COOH 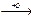 CO2 + H2O
CO2 + H2O

 R-CH-COOH + 1/2 O2 à R-CH-COOH + NH3
R-CH-COOH + 1/2 O2 à R-CH-COOH + NH3




