Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение рН, кислотности и щелочности водыСодержание книги
Поиск на нашем сайте Одним из показателей качества воды, позволяющих судить о химических и биологических процессах протекающих в ней, является значение рН. В природных водах, являющихся сложными растворами, концентрация ионов водорода зависит не только от диссоциации и гидролиза молекул воды, диссоциации и гидролиза солей, но и от содержания диоксида углерода и его производных, содержания гумусовых кислот и др. Основной системой, регулирующей содержание ионов водорода в природных водоемах, является так называемая карбонатная система. Углекислый газ, растворяясь в воде, частично превращается в угольную кислоту, способную диссоциировать по уравнению: Н2СО3ÛНСО3-+Н+ Содержание ионов водорода определяется из соотношения:
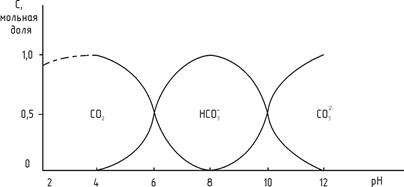
где К1 – первая константа диссоциации, равна 4.10-7. Существенное влияние на содержание ионов водорода оказывает имеющиеся в воде гидрокарбонаты Са(НСО3) и Мg(НСО3)2, которые в результате диссоциация увеличивают содержание в воде ионов НСО3- и уменьшают содержание Н+. Ионы НСО3- также диссоциируют с образованием протонов: НСО3- Условиям равновесия обычно отвечают следующие переходы: СО2 + Н2О Из уравнения видно, что различное значение рН воды указывает на различное содержание в воде различных составляющих данного уравнения. При нормальных условиях рН природных вод близко к значению 8,5. При этом значении распространен гидрокарбонатион НСО3-. В этой форме углерод легко усваивается водными организмами. Содержание ионов водорода в природных водах может меняться в довольно широких пределах (рН = 4...9). Количественное соотношение между различными соединениями углекислоты определяется уравнениями диссоциации I и II ступени, которые зависят от концентрации ионов водорода, поэтому существование различных форм углекислоты в растворе определяется рН. При рН до 3,7-4,0 вся находящаяся в воде углекислота представлена только диоксидом углерода. По мере повышения рН доля СО2 уменьшается, а следовательно, возрастает доля гидрокарбонатов – НСО3-. При рН = 8,3-8,4 практически вся углекислота находится в виде гидрокарбонта (98%), а на долю СО2 + СО32- приходится менее 2%. При дальнейшем повышении рН свободного СО2 в воде нет, а только НСО3- и СО32-. При рН = 12 в растворе находятся только карбонаты. Зависимость содержания различных соединений углерода от рН приведена на рис. 2.
Рис. 2. Содержание различных форм углерода в зависимости от величины рН
Защелачивание водоемов свидетельствует об интенсивном процессе фотосинтеза. Закисление говорит о наличии гумусовых кислот. Изменение рН может быть вызвано гидролизом солей тяжелых металлов, поступлением кислых или щелочных стоков и другими причинами. Карбонатная система обладает буферными свойствами и способна поддерживать определенное значение рН и нейтрализовать поступление кислыхили щелочных стоков. К основным характеристикам природных вод относят их кислотность и щелочность. Под кислотностью понимают содержание в воде веществ, способных вступить в реакцию с сильными щелочами. К этим веществам можно отнести: а) сильные кислоты, полностью диссоциирующие в воде; б) слабые кислоты (уксусная, сернистая, угольная и др.); в) катионы слабых оснований (ионы аммония, железа, органических оснований и др.). Соединения, содержащие эти катионы, гидролизуются с образованием ионов водорода. При аналитическом определении кислотности вода различают общую и свободную кислотность. Свободная кислотность – это кислотность, которую обнаруживают при титровании щелочью до рН = 4,5. Общая кислотность определяется суммарным количеством щелочи (мг-экв/л), пошедшей на титрование до щелочной среды (до рН ~ 8,3), Полагают, что в этом случае будут нейтрализованы все вещества, обусловливающие кислотность. Щелочность воды обусловлена наличием растворимых оснований, средними и кислыми солями, обычно гидрокарбонатами щелочных и щелочноземельных металлов. Определяется щелочность воды титрованием сильными кислотами. Различают свободную и общую щелочность. Если рН воды > 8,3, то количество кислоты (мг-экв/л) необходимое для снижения рН до 8,3, будет характеризовать свободную щелочность. При дальнейшем титровании до рН =4,5 определяют суммарное количество кислоты, которое характеризует общую щелочность воды. Цель работы: научиться определять рН воды, кислотность и щелочность природных вод различными методами, анализировать причины, влияющие на данные свойства вод. Оборудование и реактивы: иономер универсальный ЭВ-74; стеклянный и хлорсеребряный электроды; фенолфталеин, 1%-ный спиртовой раствор; метиловый оранжевый, 1%-ный спиртовой раствор; едкий натр (или калий), 0,1 н. раствор; серная кислота, 0,1 н. раствор. Порядок выполнения работы
|
||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1148; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.009 с.) |

 ,
, Н++ СО32-
Н++ СО32- Н+ + НСО3-
Н+ + НСО3-  2Н+ + СО32-
2Н+ + СО32-