
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение содержания азота и кислорода в атмосферном воздухеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ Современному специалисту в области охраны окружающей среды и рационального природопользования необходимо уметь предвидеть последствия внедрения новых технологий, знать особенности поведения различных химических соединений при их поступлении в окружающую среду, оценивать их воздействие на биосферные процессы. Глобальные процессы, происходящие в окружающей среде и обусловленные как природными, так и техногенными факторами, свидетельствуют о тесной взаимосвязи между явлениями, протекающими с участием абиотических компонентов в различных геосферах, и биогеохимическими циклами. Эту взаимосвязь изучает научное направление – химия окружающей среды, основателем которого по праву является В.И. Вернадский, изложивший основные положения новой науки в книге «Химическое строение биосферы Земли и ее окружение». Данные методические указания предназначены для студентов специальности 280201 – Охрана окружающей среды и рациональное использование природных ресурсов и включают краткие теоретические сведения по основным разделам дисциплины «Химия окружающей среды», рекомендации к выполнению лабораторных работ, контрольные вопросы для самостоятельной подготовки студентов. Список пособий, монографий, статей, приведенный в каждом разделе, поможет студентам найти ответы на поставленные вопросы. Данное издание является дополненным и переработанным лабораторным практикумом, где авторы учли сделанные замечания по совершенствованию методических указаний. Авторы выражают глубокую благодарность профессору кафедры физической и коллоидной химии Слюсарю А.А. за ценные замечания и предоставленные дополнительные материалы при подготовке методических указаний.
I. ХИМИЯ АТМОСФЕРЫ
Лабораторная работа № 1 Определение содержания азота и кислорода в атмосферном воздухе Порядок выполнения работы U-образную трубку заполняют цеолитом. Заполненную колонку присоединяют к хроматографу "Хром-4". Кран-дозатор заполняют пробой воздуха. Затем включают ток газо-носителя гелия, подаваемого из баллона, продувают всю систему (кроме крана дозатора) и устанавливают самописец на нулевой линии. Вводят пробу, продувая кран-дозатор гелием. До начала анализа самописец вычерчивает нулевую линию. При правильном проведении анализа самописец должен вычерчивать на кривой два пика. Пик кислорода (первый пик) появится приблизительно на четвертой минуте, а пик азота (второй пик) – на седьмой минуте от момента ввода пробы воздуха для анализа. Когда перо самописца возвратится на исходную нулевую линию, анализ считают законченным и прекращают подачу тока газоносителя. По площади пика кислорода и азота определяют относительное содержание составных частей воздуха. Для количественного определения каждого из компонентов, содержащихся в воздухе, пользуются хроматограммой, полученной при помощи дифференциальных детекторов. Концентрация компонентов в исследуемой пробе пропорциональна площади соответствующих пиков хроматограммы и может быть определена по формуле: S = h × μ, где h – высота пика, мм; μ – расстояние от точки ввода пробы до середины основания пика, мм. Расчет проводят по методу "нормировки", который основан на том, что сумма площадей всех пиков на хроматограмме с учетом соответствующих поправочных коэффициентов принимается за 100%, а площадь каждого составляет определенную часть от суммы площадей всех пиков. Метод не требует точного знания количества вводимой пробы, но дает возможность определять процентное содержание всех компонентов смеси. При расчете пользуются формулой
где ki – коэффициент, определяемый чувствительностью данного детектора к данному компоненту; Si – площадь пика конкретного вещества, мм2; сi – концентрация компонента, %. Требования к отчету В отчете приводят название, цель и сущность работы, хроматограммы атмосферного воздуха, результаты расчетов содержания кислорода и азота. Обосновывают полученные данные.
Лабораторная работа № 2 И в воздухе помещения Атмосфера достаточно прозрачна для коротковолнового излучения Солнца и плохо пропускает длинноволновое (инфракрасное) излучение, переизлученное нагретой земной поверхностью, что вызывает относительно усиленный нагрев приземных слоев воздуха, называемый «парниковым эффектом». Пропускание атмосферой инфракрасного излучения зависит от содержания в ней «парниковых газов», к которым в первую очередь относятся диоксид углерода (CO2), метан (CH4), пары воды (H2O), хлорфторуглеводороды (фреоны), гемиоксид азота (N2O), а также тропосферный озон (O3). Принцип метода определения содержания углекислого газа в воздухе открытой атмосферы и внутри помещения основан на том, что при пропускании воздуха через поглотительный раствор, содержащий ионы аммония, протекает реакция нейтрализации по схеме:
H2CO3 + 2NH4OH → (NH4)2CO3 + 2H2O Завершение реакции – изменение окраски поглотительного раствора –устанавливается по фенолфталеину. Цель работы: методом химического анализа определить содержание углекислого газа в атмосфере.
Оборудование и материалы: шприцы объемом 20–50 см3, лист белой бумаги, стеклянные емкости с крышками объемом 20 см3, цилиндр объемом 10 см3, поглотительный раствор (к 500 см3 дистиллированной воды добавляют 0,04 см3 25%-ного водного раствора аммиака и 1-2 капли 1%-ного раствора фенолфталеина). Порядок выполнения работы: I. Определение содержания углекислого газа в атмосфере На первом этапе работы проводят исследование воздуха открытой атмосферы (вне помещения). Для этого с помощью цилиндра отмеряют 10 см3 поглотительного раствора, помещают его в стеклянную емкость и плотно закрывают крышкой. С помощью шприца отбирают определенный объем воздуха и выпускают его в емкость с поглотительным раствором. Не вынимая шприц, энергично встряхивают емкость с поглотительным раствором до поглощения углекислого газа из воздуха в объеме поглотительного раствора. Эту процедуру повторяют до полного обесцвечивания раствора. Объем воздуха, пошедший на обесцвечивание раствора можно рассчитать, зная количество ходов поршня шприца при заборе воздуха и объем шприца, занимаемый воздухом. Эксперимент повторяют с воздухом помещения (исследуемой зоны), для чего стеклянную емкость, предварительно ополоснутую дистиллированной водой, заполняют свежей порцией поглотительного раствора.
где V − объем воздуха открытой атмосферы, пошедший на обесцвечивание поглотительного раствора, м3; V1 − объем воздуха исследуемой зоны, пошедший на обесцвечивание поглотительного раствора, м3; 0,04 − содержание углекислого газа в воздухе, %. II. Определение вентиляционного объема воздуха Расчет необходимого вентиляционного объема воздуха (м3/ч ), т.е. объема свежего воздуха, который надо подавать в помещение на одного человека, чтобы содержание СО2 не превысило допустимого уровня (0,1%), произвести по следующему соотношению:
 , ,
где К − количество литров СО2, выдыхаемое одним человеком за один астрономический час при спокойной работе в положении сидя (для взрослого, в среднем − 22,6 л/ч); р − предельно допустимое содержание СО2 в воздухе учебного помещения (0,1% или 1 л/м3); Х − концентрация СО2 в исследуемой зоне (% или л/м3). Зная вентиляционный объем воздуха, рассчитать коэффициент вентиляции (W), который показывает, сколько раз в течение 1 часа воздух помещения должен смениться, чтобы содержание СО2 не превысило допустимого уровня:
 . .
где Vв.к − воздушный куб, м3, приходящийся на одного человека (физиологическая норма на человека в час – 15−20 м3, гигиеническая норма – 4,5−5,0 м3 на одного человека); V − объем исследуемой зоны (учебного помещения), м3; n − количество человек, находящихся в зоне. Требования к отчету В отчете приводят результаты расчетов содержания углекислого газа в воздухе помещения, вентиляционного объема воздуха, коэффициента вентиляции. Обосновывают полученные данные, предлагают мероприятия по снижению содержания углекислого газа в воздухе помещения.
Лабораторная работа № 3 Порядок выполнения работы Набрать в шприц воздух и под давлением ввести через иглу в емкость с поглотительным раствором. Воздух пропускать до изменения окраски раствора. Определить объем воздуха, израсходованного на изменение окраски поглотительного раствора, зная число ходов поршня и заполняемый воздухом объем шприца. Расчет произвести по формуле: С NH3 = где СNH3 – концентрация аммиака, мг/м3; 1020 – масса аммиак, мг в 1 дм3 раствора; V1− объем поглотительного раствора, см3; V2 – объем анализируемого воздуха, см3. Требования к отчету В отчете приводят результаты расчетов содержания аммиака воздухе помещения. Обосновывают полученные данные. Вопросы для самоподготовки 1. Строение атмосферы. Химический состав различных слоев атмосферы. 2. Понятие о фотохимических реакциях. Законы фотохимии. 3. Характеристика солнечного излучения. 4. Основные типы физико-химических процессов в ионосфере. 5. Озоновый слой планеты. Атмосферные реакции с участием озона. 6. Свободные радикалы в тропосфере и стратосфере. Превращения гидроксидного и гидропероксидного радикалов. 7. Реакции метана и его гомологов в атмосфере. Превращения алкенов. 8. Образование и превращения пероксиацетилнитрата (ПАН). 9. Превращения бензола и его производных в атмосфере. 10. Пути образования и превращения альдегидов и кетонов. 11. Реакции оксидов азота. 12. Фотохимический смог, продукты. Условия возникновения. 13. Аэрозоли, их классификация, источники образования и пути вывода. 14. Конденсация паров воды в атмосфере. Облачность. Дожди. 15. Фреоны в атмосфере. Пути поступления и превращения. 16. Кислотные дожди. Пути образования, состав дождей. II. ХИМИЯ ГИДРОСФЕРЫ Лабораторная работа № 4 Порядок выполнения работы Требования к отчету В отчете приводят название, цель и сущность работы, графики рН = f (Vщ); рН = f (Vк) результаты расчета кислотности и щелочности воды, делают предположения о процессах, протекающих в исследуемой воде. Лабораторная работа № 5 Порядок выполнения работы Определение сухого остатка В прокаленную, охлажденную и взвешенную формовую или кварцевую чашку помещают 30...35 мл анализируемой пробы воды. Воду выпаривают на водяной бане досуха. Затем переносят чашку с остатком в сушильный шкаф и высушивают до постоянной массы при 103...105 °С. Содержание сухого остатка, мг/л, рассчитывают по формуле
где а – масса чашки с сухим остатком, мг; b – масса пустой чашки, мг; V - объем анализируемой пробы воды, мл. Требования к отчету В отчете привести название, цель и сущность работы, результаты расчета сухого и прокаленного остатка, видов жесткости. По результатам анализа сделать вывод о принадлежности исследуемой воды к определенной группе жесткости. Сделать предположение о характере подстилающих пород и поступающих стоков. Лабораторная работа № 6 Порядок выполнения работы Определение хлорид-ионов Метод основан на титрометрическом осаждении хлоридов в нейтральной среде или слабощелочной среде нитратом серебра в присутствии бихромата калия в качестве индикатора. В пробу воды объемом 100 мл добавляют 10 капель раствора хромово-кислого калия, хорошо перемешивают и оттитровывают раствором азотнонокислого серебра. Раствор титранта добавляют до тех пор, пока в воде не появится устойчивый бурый оттенок, свидетельствующий об образовании хромата серебра. Содержание хлорид-ионов в пробе воды составит, мг/л:
где V1 – объем раствора нитрата серебра, пошедшего на титрование, мл; N1 – нормальность раствора нитрата серебра; Э – миллиграм-эквивалент хлора; V2 – объем исследуемой воды. Определение фосфатов Сущность заключается в том, что сульфомолибдатный раствор, введенный в испытуемую пробу воды в присутствии погруженной с нее оловянной палочки, реагирует с фосфатами, в результате чего вода окрашивается в синий цвет, интенсивность которого тем больше, чем выше концентрация фосфатов в воде. В мерную пробирку наливают 2 мл отфильтрованной пробы воды, доводят объем жидкости сульфомолибдатным раствором до 10 мл. Затем в раствор опускают очищенную наждачной бумагой и ополоснутую дистиллированной водой оловянную палочку. Через 5 мин (за это время раствор в пробирке вместе с оловянной палочкой должен быть 2...3 раза перемешен легким встряхиванием) оловянную палочку вместе с пробкой вынимают из пробирки и сравнивают окраску испытуемого раствора с окраской стандартной цветной шкалы. Для этого пенал, в котором находится штативчик с фосфатной шкалой, снимают с задней стенки лабораторного ящика, вынимают штативчик и в него вставляют (через верхнее отверстие) мерную пробирку так, чтобы она оказалась в специальном гнезде на фоне молочного стекла рядом с ячейками цветной шкалы. Позади штативчика должен находиться источник света расположенный так, чтобы окраска исследуемого раствора сравнивалась с окраской штатной шкалы в рассеянном проходящем свете. Фосфатное число воды соответствует цифре, стоящей против ячейки шкалы, окраска которой совпадает с окраской раствора в пробирке или наиболее близка к ней. Результаты определения выражены в виде концентраций фосфат ионов PO43- (мг/л). Фосфатную шкалу следует хранить в футляре. Она должна быть на свету только во время колориметрирования. Определение нитратов Определение нитратов проводят с помощью нитратомера, используя ионоселективный электрод. Предварительной частью работы является подготовка нитратомера. Сначала электроды готовят к работе. Для этого внутрь хлорсеребряного электрода (вспомогательного) заливают насыщенный раствор KCl и выдерживают сутки в стакане с насыщенным раствором. Между испытаниями такой электрод хранят в дистиллированной воде. Ионоселективный электрод ЭМ-NO3-01 заполняют после промывки при-электродным раствором, который содержит 10,11 г KNO3 и 0,37 г KCl на 1 л раствора. Выдерживают в растворе KNO3 с концентрацией 10-1 моль/л в течение суток. Приготовленные таким образом электроды готовы к работе. Их подключают в соответствующие гнезда прибора и производят калибровку системы. Для этого электроды сначала погружают в 10-4 М раствор KNO3 и включают прибор нажатием кнопки "вкл". Затем нажимают кнопку "изм". ВНИМАНИЕ! Эту кнопку можно нажимать только в том случае, если электроды погружены в раствор. С помощью регулировки ручек выставляется "0" на шкале прибора. Отжать кнопку "изм" и перенести электроды, предварительно вымыв в дистилляте и высушив фильтровальной бумагой, в стандартный раствор с концентрацией 10-3 М KNO3. Нажать кнопку "изм" и ручкой "крутизна" выставить значение 56 мВ (при нажатой кнопке "диап" шкала прибора соответствует 100 мВ, при отжатой – 200 мВ). Для проверки правильности калибровки перенести электроды в 10-2 М раствор KNO3. Показания прибора должны соответствовать 112 мВ. Если показания не соответствуют 112 мВ, произвести повторную настройку прибора по растворам. Непосредственные измерения заключаются в следующее. В пробу воды помещают электроды, включают прибор и через 1...2 мин снимают показания прибора. Сравнивая показания прибора с данными настройки, рассчитывают содержание нитрат-ионов в исследуемой пробе. Требования к отчету В отчете приводится описание хода выполнения работы, результаты расчета содержания анионов. Сделать предположение о характере подстилающих пород и поступающих стоков. Выявить последствия для водной экосистемы от избыточного поступления анионов.
Лабораторная работа № 7 Порядок выполнения работы Отбирают 5 мл пробы, в пробу вводят 2,5 мл 0,25 н. раствора бихромата калия, затем 0,2 сульфата ртути (II) и при перемешивании 7,5 мл концентрированной серной кислоты. При этом температура раствора поднимается выше 100 °С. Через 2 мин. охлаждают раствор до комнатной температуры, приливают 100 мл дистиллированной воды и титруют избыток бихромата. Для этого вводят 10-15 капель раствора N - фенилантраниловой кислоты и оттитровывают раствором соли Мора. Проводят холостой опыт. Для этого берут 5 мл дистиллированной воды и проводят то же операции. Определяют число миллиграммов О2 на 1 л воды:
где b – объем раствора соли Мора, пошедшего на титрование холостой пробы; a – объем раствора соли Мора, пошедшего на титрование пробы; N – нормальность соли Мора; V – объем анализируемой пробы; 8 – эквивалент кислорода. Из оставшейся пробы берут несколько аликвотных частей по 10 мл и вливают в колбы на 50 мл в каждую. Оставляют на несколько дней хранения (по указанию преподавателя) при t = 20°С, плотно закрыв колбы притертой крышкой или пробкой. По истечении указанного времени вновь определяют количество кислорода, пошедшего на окисление, по приведенной выше методике. Повторяют анализ многократно в течение нескольких сроков хранения. Склянки с такой емкостью и содержанием пробы всего 10 мл содержат достаточное количество кислорода, который потребляется для биологического окисления, содержащихся в пробе органических соединений. Разность между количеством кислорода, поведшим на химическое окисление в начальный период и через заданные промежутки времени, показывает то количество кислорода, которое использовали микроорганизмы на окисление соединений, содержащихся в воде. Требования к отчету В отчете приводят название и цель работы, результаты расчета потребленного кислорода, график О(мг) = f (t сут), делают предположение о биологической продуктивности водоема, интенсивности естественных окислительных процессов с использованием данных Приложения 3 и 4.
Вопросы для самоподготовки 1. Особенности воды как растворителя, структура водных растворов. 2. Аномальные свойства вода. 3. Ионное произведение воды. Водородный показатель. 4. Буферные системы, механизм действия буферных систем. 5. Кислотность. Виды кислотности. 6. Щелочность. Виды щелочности. 7. Жесткость воды. Виды жесткости. Способы определения общей, карбонатной и некарбонатной жесткости воды. 8. Способы умягчения воды при водоподготовке. 9. Последствия потребления жесткой воды для живых организмов. 10. Последствия использования жесткой воды в паросиловом хозяйстве. 11. Виды природных вод и особенности их состава. 12. Карбонатная система природных вод, ее связь с рН среды. 13. Растворимость карбонатных пород и ее влияние на рН среды. 14. Окислительно-восстановительный потенциал природных вод. 15. Процессы окислительного разложения целлюлозы. 16. Окисление жиров в гидросфере. 17. Процессы разложения белков в гидросфере. 18. Процессы нитрификации и денитрификации. 19. Пути образования метана и сероводорода в анаэробных условиях. 20. Термическая и химическая стратификация природных водоемов. 21. Причины и пути эвтрофикации водоемов.
III. ХИМИЯ ЛИТОСФЕРЫ
Лабораторная работа № 8 Порядок выполнения работы Для работы собирают установку, представленную на рис. 3. В делительную воронку, на предварительно положенный фильтр из стекловаты, помещают навеску исследуемой почвы массой ~ 20 г. Через воронку с почвой медленно пропускают 100 мл 0,1 н. раствора НСl. Затем почву в воронке многократно промывают водой, пропуская ее через воронку до тех пор, пока капля, вытекающая из воронки, покажет нейтральную реакцию по бумажке индикатора.
Рис. 3. Установка для определения обменной емкости почв: 1 – делительная воронка; 2 – фильтр; 3 – почва
В колбу для титрования помещают 10 мл 0,1 н. раствора СаCl2, разбавляют дистиллированной водой в 5 раз, затем добавляют 5 мл аммиачной буферной смеси и 4…5 капель индикатора темно-синего хрома, который дает розово-красное окрашивание. Раствор титруют 0,1 н. раствором трилона Б и записывают объем, пошедшего на титрование (Vmp). Затем в делительную воронку заливают 0,1 н. раствор CaCl2 и медленно пропускают через кран прошедший через почву раствор со скоростью 1…2 капли в секунду. Выходящий раствор собирают в колбу для титрования по 10 мл в каждую, затем разбавляют в 5 раз, добавляют 5 мл аммиачной буферной смеси, вносят индикатор и титруют трилоном Б, определяя объем титранта (V1, V2 …Vn) пошедший на титрование каждой колбы. Раствор, выходящий из воронки прекращают собирать, когда объем титранта, пошедший на титрование последней пробы (Vn), станет равным объему, пошедшему на титрование исходного раствора CaCl2 (Vmp). По результатам титрования строят график V титранта = f (V элюента), общий вид которого представлен на рис. 4.
Рис. 4. График зависимости объема титранта от объема элюента
По графику находят объем титранта Vg и Vn, которые используют в расчетах динамической и полной емкости обмена почвы (Tg, Тn). Под динамической обменной емкостью понимают емкость почвы, когда связываются все ионы, проходящие через почву (до "проскока" ионов). Под полной объемной емкостью понимают максимальное количество ионов, которые способна поглотить почва. Расчет ведут по следующим формулам, мг-экв/100 г:
где Vg и Vn – объем элюента, мл (находят по графику); NCaCl2 – исходная концентрация раствора CaCl2, найденная титрованием трилоном Б; m – масса навески почвы.
Требования к отчету В отчете следует привести краткое описание работы, дать понятие об обменных реакциях ППК, дать определение динамической и полной обменной емкости, привести результаты расчетов, на основе полученных данных сделать вывод о типе исследуемой почвы. Лабораторная работа № 9 Порядок выполнения работы Взвешивают 40 г сухой просеянной почвы, помещают в колбу, приливают 100 мл 1,0 н. раствора КСl и интенсивно взбалтывают смесь в течение 10…15 мин. Отфильтровывают солевую вытяжку через складчатый фильтр. В две конические колбы приливают по 25 мл фильтрата в каждую и кипятят содержимое колбочек ~ 5 мин. для удаления CO2. В одной колбе горячую вытяжку оттитровывают 0,02 н. раствором NaOH в присутствии 2…3 капель фенолфталеина. Во вторую колбу после кипячения добавляют 1 мл 3,5%-ного раствора NaF, охлаждают и титруют 0,02 н. раствором NaOH в присутствии фенолфталеина. Содержание алюминия рассчитывают по формуле:
где А − содержание алюминия, мг на 100 г почвы; а − количество NaOH, израсходованное при горячем титровании, мл; b − количество NaOH, израсходованное при холодном титровании, мл; 100 − коэффициент пересчета на 100 г почвы; 0,18 – коэффициент пересчета алюминия в мг (1 мл 0,02 н. NaOH соответствует 0,18 мг алюминия); m − навеска почвы, соответствующая взятому для одного титрования объему жидкости. Требования к отчету Отчет должен содержать описание хода работы, результаты определений и расчет содержания подвижного алюминия, предварительное заключение о пригодности почвы для жизнедеятельности растений и микроорганизмов. Лабораторная работа № 10 Порядок выполнения работы 0,1…0,3 г почвы отдельно от растительных остатков и просеянной через сито 0,25 мм, помещают в коническую колбу на 100 мл. Из бюретки приливают точно 10 мл 0,4 н. раствора K2Cr2O7 в кислоте. Осторожно круговыми движениями взбалтывают содержимое. В горло колбы вставляют воронку, служащую холодильником, и кипятят содержимое на водяной бане 4-5 мин. Содержимое колбы периодически встряхивают. Отсчет времени начинают с момента появления пузырьков газа. Кипение должно быть медленным. При нагревании идет реакция 2 K2Cr2O7 + 8Н2SO4 + 3C(гумус) à 2K2SO4 + 2Cr2(SO4)3 + 8H2O + 3CO2 По окончании кипения колбу вынимают из водяной бани, охлаждают до комнатной температуры. Переносят содержимое в колбу на 250 мл, смывают дистиллятом остатки с воронки и маленькой колбы и тоже переносят вместе с дистиллятом в колбу на 500 мл. Доводят содержимое большой колбы до 250 мл. Добавляют 2 мл 85%-й Н3РО4 и восемь капель дифениламина в качестве индикатора (вместо дифениламина можно использовать 5…8 капель 2%-ного раствора N-фенилантраниловой кислоты). Содержимое колбы оттитровывают 0,2 н. раствором соли Мора до перехода темно-бурой окраски через фиолетовую и синюю в грязно-зеленую. При появлении синего цвета титровать нужно осторожно. Параллельно нужно провести холостое титрование. Для этого взять 0,2 г прокаленного песка, поместить в коническую колбу на 100 мл, прилить из бюретки 10 мл 0,4 н. раствора K2Cr2O7, закрыть воронкой, прокипятить 4-5 мин. на водяной бане, охладить и оттитровать. Вычислить процентов содержание гумуса по формуле:
где a − объем раствора соли Мора, затраченной на холостое титрование 10 мл хромовой смеси, мл; в − объем раствора соли Мора, затраченный на титрование содержимого колбы после окисления гумуса, мл; N - поправка к титру соли Мора; 100 – коэффициент пересчета на 100 гпочвы; 0,0010362 − коэффициент пересчета на гумус (показывает, что 1 мл 0,2 н. раствора соли Мора соответствует такому количеству хромовой кислоты, которое окисляет 0,0010362 г гумуса или 0,0006 г углерода), W − влажность в пересчете на абсолютно сухую почву, %; С – навеска почвы, г. Одновременно с анализом почвы определяют ее влажность для пересчета результата на абсолютно сухую почву. Влажность почвы W, % определяют по формуле: где m1 − масса влажной почвы со стаканчиком, г; m0 − масса абсолютно сухой почвы со стаканчиком, г; m − масса стаканчика, г. Требования к отчету К отчету следует представить описание хода выполнения работы, результаты титрования, расчеты содержания гумусовых веществ в почве. Лабораторная работа № 11 Требования к отчету К отчету следует представить описание хода работы, результаты потенциометрических определений, расчет нитрифицирующей способности. Лабораторная работа № 12 Лабораторная работа № 13 Порядок выполнения работы Комнатное растение помещают на сутки в темноту. За это время в растении почти полностью исчезает крахмал, который расходуется на дыхание, переходя под действием ферментов в сахар и оттекая из листа. Через сутки выносят растение на свет, срезают с него лист. На лист прикрепляют полоску темной бумаги, согнутую пополам так, чтобы она закрывала часть листа с двух сторон. Лист помещают в стакан с водой. Накрывают лист стеклянным колпаком и в течение 2…3 ч освещают светом настольной лампы, ориентируя ее так, чтобы лучи падали на лист перпендикулярно его поверхности. Одновременно выполняют анализ другого листа с того же растения. Для этого срезают лист, опускают его в кипящую воду и кипятят в течение 5 мин. Затем лист переносят в спирт и обесцвечивают его. Обесцвеченный лист обрабатывают раствором йода в йодиде калия. Отмечают отсутствие или слабую реакцию на крахмал. Выдержав нa свету, лист с бумажкой также кипятят в течение 5…10 мин, затем выдерживают в спирте до полного обесцвечивания. Расправляют пластинку листа в чашке Петри и наносят на нее раствор йоде в йодиде калия. Отмечают положительную реакцию на крахмал в местах, освещаемых лампой, и отсутствие реакции на крахмал в той части листа, которая была прикрыта бумажкой.
Требования к отчету В отчете приводят название, краткое описание работы, основные реакции фотосинтеза органических соединений в рассчитанных тканях, объясняют наблюдаемые в работе явления. Вариант 2 Исследования фотосинтезирующей деятельности земных водорослей и влияние токсичных соединений на фотосинтез водорослей Цель работы: исследовать активность фотосинтеза одноклеточных зеленых водорослей, оценить степень влияния производных фенола на активность фотосинтеза. Оборудование и реактивы: термостатированная камера, кислородомер (оксидиметр с мембранным электродом), культура водоросли, растворы производных фенола (10-4 М растворы фенола, метилфенола, диметилфенола и др.). Порядок выполнения работы Ячейку камеры объемом ~ 20 см3 заполняют культурой водорослей, включают мешалку, освещение и подключают датчик кислорода (рис. 6).
Рис. 6. Схема камеры исследования фотосинтеза: 1 – камера; 2 – ячейка; 3 – магнитная мешалка; 4 – датчик кислорода; 5 – осветительные лампы
Регистрируют изменения концентрации кислорода в процессе фотосинтеза, записывая показания прибора через определенные промежутки времени. Включает источник света и наблюдают за процессом дыхания водорослей, также фиксируя показания прибора через определенные промежутки времени. Затем с помощью пипетки вводят в ячейку камеры 5 мл раствора фенола. Включают источник света и фиксируют показания содержания кислорода через такие же промежутки времени как и в первом случае. Выключают источник света и продолжают измерения. Строят графики зависимости содержания кислорода в ячейке от времени освещения и затемнения для чистой и для зараженной культуры. Опыты повторяют, но используют другое производное фенола. Сравнивая графики, делают вывод о влиянии различных соединений на активность фотосинтеза. Требования к отчету В отчете следует привести описание работы, основные реакции фотосинтеза, прокомментировать наблюдаемые явления, сделать вывод об относительной токсичности производных фенола. Вопросы для самоподготовки 1. Что понимают под фотосинтетической деятельности растений? Приведите основные реакции. 2. Продуктивность экологической системы. Виды продуктивности. 3. Первичные продукты фотосинтеза, их дальнейшие превращения. 4. Фотосинтез и миграции кислорода и углерода. 5. Основные лимит
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1362; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.02 с.) |

 %,
%, ,
, ,
, ,
, ,
, 
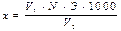 ,
,


 ;
; ,
, ,
,
 ,
,



