
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реагентные способы разделения сожСодержание книги Поиск на нашем сайте
ЛАБОРАТОРНАЯ РАБОТА №1 ЛАБОРАТОРНАЯ РАБОТА №2 УМЯГЧЕНИЕ, ОБЕССОЛИВАНИЕ И ОБЕСКРЕМНИВАНИЕ ВОДЫ МЕТОДОМ ИОННОГО ОБМЕНА
Цель работы - изучение отдельных физико-химических свойств воды и методов ее деминерализации (обессоливания и умягчения).
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Вода - самое распространенное минеральное природное соединение на Земле. В естественных условиях вода не встречается в химически чистом состоянии, поскольку, соприкасаясь с воздухом, почвой, осадочными породами, насыщается различными примесями, растворенными и нерастворенными веществами. Растворенные соединения (органические и неорганические) находятся в воде в виде ионов, нерастворенные (так же неорганические и органические) - в виде грубодисперсных примесей (ГДП), а так же в составе коллоидных примесей. Кроме того, в природной воде присутствуют растворенные газы (кислород, азот, углекислый газ и др.) и различные микроорганизмы, животного и растительного происхождения (бактерии, вирусы, водоросли и пр.) Таким образом, природная вода представляет собой сложную динамическую систему, содержащую газы, минеральные и органические вещества, в растворенном, коллоидном или взвешенном состоянии. Основные ионы можно расположить по частоте их присутствия в воде в порядке убывания:
В поверхностных водах часто присутствует также кремниевая кислота
1.1. Физико-химические свойства воды. Понятие – жесткость воды
Все природные воды по преобладающему иону делятся на три группы: гидрокарбонатные ( Вода характеризуется определенной величиной активной реакции среды ( В зависимости от солесодержания природные воды подразделяются на пресные (до 1,0 г/кг); солоноватые (1-10 г/кг) и соленые (более 10 г/кг). Для оценки суммарного солесодержания и органических примесей, содержащихся в воде в истинно растворенном и коллоидном состоянии, используется показатель – сухой остаток. Числовое значение его определяется взвешиванием остатка после выпаривания определенного объема профильтрованной воды и выражается в мг/л. Часть сухого остатка, которая удаляется при последующем прокаливании его, дает ориентировочно представление о содержании в воде органических веществ. Жесткость воды – один из важнейших показателей качества воды. Жесткость воды обусловлена наличием в ней солей кальция ( Временная (карбонатная или устранимая) Жк связана, в основном, с присутствием растворенных гидрокарбонатов кальция и магния
Постоянная жесткость (некарбонатная жесткость) Жн определяется содержанием в воде хлоридов, сульфатов, нитратов кальция и магния, остающихся и после кипячения в растворенном состоянии. Сумма временной и постоянной жесткости называется общей жесткостью. Единицей измерения жесткости в РБ и странах СНГ является величина, характеризующая концентрацию различных ионов в единицах, которые учитывают их молярную массу и электрический заряд – грамм-эквивалент на литр раствора (г-экв/л). Или частное от деления единицы количества вещества (моля) на величину суммарного электрического заряда созданного ионом (или валентность). При водоподготовке чаще используют более мелкую единицу, чем г-экв/л - миллиграмм-эквивалент в литре (мг-экв/л), составляющей одну тысячную долю грамм-эквивалента (жесткость в 1 мг-экв/л отвечает содержанию 20,04 мг/л В других странах принято обозначать жесткость воды в условных градусах (немецкий, английский и пр. градусы). Вода с жесткостью до 4 мг-экв/л характеризуется как мягкая; от 4 до 8 – средней жесткости, от 8 до 12 – жесткая. Общая жесткость питьевой воды – 7 мг-экв/л, в исключительных случаях допускается 10 мг-экв/л (стандарт на питьевую воду). Для использования воды в производстве, а так же в быту из нее удаляют все примеси, которые могут оказать вредное воздействие на оборудование, качество целевого продукта иди здоровье человека. Этот процесс получил название “ водоподготовка”. Требования, предъявляемые к качеству воды в быту и в производстве различные, поэтому используются различные приемы очистки и их сочетания: механическая, физическая, химическая. Данная работа предусматривает знакомство с приемами водоподготовки, направленными на умягчение, обессоливание и обескремнивание водопроводной воды.
1.2. Умягчение и обессоливание воды
Артезианская вода, которая используется, в основном, в Республике Беларусь, характеризуется достаточно высокой карбонатной жесткостью, поэтому нуждается в умягчении. Умягчение может проводиться несколькими методами: термическим, химическим и катионным. Перед умягчением воды из нее удаляются взвешенные и коллоидные примеси.
Термический метод При нагревании воды гидрокарбонаты кальция и магния переходят из раствора в трудно растворимые соли -
Химический метод Вода обрабатывается известью, содой (содово-известковый метод), а также серной или соляной кислотой. Растворенные гидрокарбонаты переходят в нерастворимые соединения, которые отделяются, либо переходят в хорошо растворимые соли, не выпадающие в осадок при нагревании воды.
Если при химическом умягчении выпадет осадок, то его отделяют (осветление воды) различными методами (отстаиванием, фильтрованием и пр.).
Ионирование (обессоливание) Умягчение воды катионированием производится путем фильтрования предварительно осветленной воды (освобожденная от взвешенных нерастворимых примесей) через катионообменную смолу (катионит), частицы которой содержат на своей поверхности катионы
Ионообменная смола (катиониты и аниониты) – нерастворимый зернистый материал, способный в водных растворах обменивать содержащиеся в нем подвижные катионы и анионы на катионы и анионы водного раствора. У катионита и анионита есть предельная возможность к обмену своих подвижных ионов ( Восстановление свойств катионита в
Восстановленные и отмытые водой ионитовые фильтры могут быть снова использованы для умягчения воды или для обессоливания. При обессоливании осуществляется удаление как катионов (аналогично удалению ионов кальция и магния), так и анионов Удаление аниона кремниевой кислоты из воды осуществляется при контакте с сильно основным анионитом.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Описание лабораторной установки
Установка (рис 1.1.) включает в себя емкость 1 для воды, поступающей на обессоливание; колонки с ионообменными смолами 2 (катионит) и 3 (анионит); емкость 4 - сборник обессоленной воды; две емкости 6 и 7 для растворов соляной кислоты и щелочи, используемых по мере необходимости, для регенерации ионообменных смол установки. Разряжение в системе создается с помощью водоструйного насоса 5.
Рис 1.1. Лабораторная установка умягчения и обессоливания воды на ионообменных смолах
2.2. Методика проведения работы
Экспериментальная работа состоит из двух частей: 1 – определение жесткости питьевой воды до и после различных методов ее умягчения, 2 – определение эффективности умягчения и обессоливания воды на ионообменных смолах в зависимости от ее расхода.
2.2.1. Определение жесткости воды
Для определения жесткости каждый вид исследуемой воды (см. п. 3) отбирают предварительно в отдельные колбы по 0,5 л. Для анализа к 100 мл пробы воды добавляют 5 мл аммиачного буферного раствора и 9-10 капель индикатора (хрома темносинего или хромогена черного). После этого смесь титруют по 1 капле 0,1 н раствором трилона Б (при интенсивном перемешивании) до изменения окраски (
2.2.2. Определение эффективности умягчения воды на ионообменных смолах
Включают водоструйный насос 5 и открывают кран на выходе из емкости 1. Вода самотеком из емкости 1 поступает в колонку 2 с катионитом, откуда за счет разряжения в системе, создаваемого водоструйным насосом, поступает в колонку 3 с анионитом и затем в емкость 4 для обессоленной воды. Расход воды на установке Устанавливают три расхода воды: максимальный, средний, минимальный. При каждом расходе воды определяют величину жесткости обессоленной воды (в трех повторностях), отбираемой из емкости 4 аналогично п. 2.2.1.
2.3. Обработка результатов эксперимента
Жесткость воды определяют по формуле:
где
Эффективность умягчения на ионообменных смолах определяют как:
где
Результаты оформляют в соответствии с таблицами 1.1. и 1.2.
Таблица 1.1. И сточных вод
Цель работы – дать общую оценку качества воды (степени ее загрязнения) по перманганатной и бихроматной окисляемости.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Общую оценку загрязненности воды, как природной, так и сточной, можно достаточно быстро получить по ее окисляемости (ХПК – химическая потребность в кислороде). Под окисляемостью понимают количество кислорода, необходимое для окисления примесей, содержащихся в одном литре (дм3) исследуемой воды (мг О2/л). Окисляемость может быть общей, т.е. показывать количество всех веществ в воде, органических и минеральных, или «окисляемость с поправкой», если определяется содержание только органических веществ. На практике при анализе воды в качестве окислителя используют не кислород, а растворы таких сильных окислителей как перманганат калия ( Происхождение и содержание органических веществ, находящихся в природных водах, весьма разнообразны. Различны и их химические свойства по отношению к кислороду: одни вещества устойчивы к окислению, другие, наоборот, легко окисляются. Прямое определение органических веществ в природных водах является сложной и трудоемкой задачей. Поэтому пользуются более простыми косвенными методами. Метод перманганатной окисляемости дает представление о содержании в воде легко окисляющихся органических веществ. Метод бихроматной окисляемости соответствует полному окислению органических веществ (легко и трудно окисляющихся), за исключением некоторых белковых соединений. Обычно перманганатная окисляемость составляет 40–50 % от истинной окисляемости органических веществ, то есть полного окисления органического углерода до СО2. Повышенная окисляемость может указывать на загрязнение воды. Наименьшую окисляемость (до 1–2 мг/л О2 ) имеют глубокие подземные воды, относящиеся к 1-му классу. Окисляемость подземных вод, относящихся ко 2-му и 3-му классам, может быть повышена, но не более 5 и 15 мг/л О2соответственно. В грунтовых водах окисляемость обычно выше (до 2–4 мг/л), причем тем больше, чем выше цветность воды. Поэтому высокая окисляемость при небольшой цветности вероятнее указывает на загрязнение воды. В воде открытых водоемов окисляемость повышается до 5–6 мг/л в реках идо 6–8 мг/л в водохранилищах, достигая еще больших величин в водах болотного происхождения. Вода считается пригодной для хозяйственных и питьевых целей, если перманганатная окисляемость ее не превышает 3,0 мг/л О2. Установлено, что с повышением содержания в воде органических веществ увеличивается и ее бактериальное загрязнение. Необходимо помнить, что при определении окисляемости воды, как перманганатной, так и бихроматной, аналитик получает условные сведения о качестве воды, указывающие лишь на химическую природу загрязнителей и их косвенное количество по израсходованному окислителю. Конкретного ответа о качественном составе загрязнителей, присутствующих в воде, окисляемость не дает. В то же время это всегда и необходимо. Так для определения оценки качества воды для различных категорий водопользования окисляемость является важнейшим показателем, т.к. дает возможность очень быстро получить ответ об общем состоянии воды в исследуемом объекте.
1.1. Перманганатная окисляемость (метод Кубеля) Метод основан на окислении органических веществ, присутствующих в воде, 0,01н раствором перманганата калия в сернокислой среде при кипячении. Этим методом можно определить окисляемость в диапазоне от 0 до 100 мг О2/л, без разбавления. Максимальная определяемая окисляемость 10 мг О2/л. Определение перманганатной окисляемости основано на том, что КМnО4в кислой среде являясь сильным окислителем, реагирует с присутствующими в воде восстановителями (органические вещества, соли железа (II), нитраты). Ион МnО- 4 принимает при этом 5 электронов и переходит в двухвалентный катион Мn2+по уравнению:
Избыток КМnО 4 реагирует с вводимой в раствор щавелевой кислотой:
Не вступившая в реакцию щавелевая кислота оттитровывается КМnО4по приведенному уравнению. Определению мешают неорганические соединения (хлориды, сульфиды, нитриты, железо (II), которые могут окисляться в условиях анализа. Если они присутствуют в анализируемой воде, их кол-во необходимо определить отдельно и вычесть результат, пересчитанный на окисляемость, из окисляемости пробы воды. 1 мг H2SO4 соответствует 0,47 мг О2; 1 мг NO2 – 0,35 мг О2; 1 мг Fe+2 – 0,14 мг O2.
1.2. Бихроматная окисляемость
В сернокислой среде с помощью бихромата калия в присутствии солей серебра (в качестве катализатора) окисляется большинство органических веществ и часть минеральных. Поэтому бихроматную окисляемость называют «общая окисляемость» или «полная окисляемость». Определению мешают хлориды, влияние которых можно исключить добавлением в пробу сульфата ртути (II). Если необходимо определить содержание только органических веществ в пробе, то необходимо с помощью других известных методов определить в ней содержание минеральных веществ, а затем эту величину (ее кислородный эквивалент) вычесть из общей окисляемости.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Определение степени загрязнения воды перманганатным методом Кубеля (питьевая вода)
Анализируемая вода должна отстояться в течение 2 часов для выделения нерастворимых примесей. Затем отбирают 100 мл пробы и помещают в коническую колбу объемом 250 мл. Для создания кислой среды приливают 5 мл разбавленной (1:3) серной кислоты, а в качестве окислителя – 10 мл 0,01 н раствора перманганата калия. В колбу опускают стеклянный шарик, накрывают воронкой и ставят на плитку. Смесь должна закипеть через 5 мин, продолжительность кипения 10 мин. При кипении раствора внимательно следят за его окраской. Если розовое окрашивание перейдет в бурое или раствор обесцветится, это свидетельствует о недостатке окислителя. В таком случае анализ данной пробы прекращается и повторяется сначала, но уже с разбавленной пробой. Если в процессе кипения цвет раствора остается розовым, то по истечении 10 мин колбу снимают с плитки, убирают прикрывающую ее воронку и прибавляют 10 мл 0,01 н раствора щавелевой кислоты. Горячую обесцвеченную смесь титруют 0,01 н раствором перманганата калия до появления слабо розового окрашивания. Следует учитывать, что для получения точных результатов необходимо, чтобы при титровании концентрированных проб расходовалось не более 12 мл 0,01 н раствора Параллельно проводят холостой опыт со 100 мл дистиллированной воды (разбавляющей), который учитывает поведение окислителя в условиях анализа. При этом расход 0,01 н раствора перманганата калия не должен превышать 0,2 мл. Окисляемость по методу Кубеля вычисляется по формуле:
где
8 – молярная масса эквивалента кислорода, г/моль;
Результаты определения округляют с точностью до 0,1 мг при значении окисляемости от 0 до 10 мг
2.2. Определение степени загрязнения методом бихроматной окисляемости (сточная вода, загрязненная вода природных источников)
Для анализа необходимо отобрать 20 мл пробы, поместить ее в колбу со шлифом для кипячения. В колбу (при необходимости) добавить 0,4 г катализатора, 10 мл 0,25 н раствора бихромата калия. Смесь аккуратно перемешивают и осторожно приливают к ней 30 мл концентрированной серной кислоты. Затем к колбе с пробой присоединяют обратный холодильник и кипятят смесь в течение 2 часов. При этом необходимо следить за цветом кипящего раствора. Если он изменился от золотисто-оранжевого к буро-зеленоватому, то определение необходимо повторить с более разбавленной пробой, т.к. это свидетельствует о недостатке окислителя. Если цвет не изменился, то по истечении указанного времени охлаждают систему, отсоединяют холодильник и приливают в колбу 100 мл дистиллированной воды. Разогревшуюся смесь вновь охлаждают, прибавляют 3-5 капель индикатора и избыток бихромата калия оттитровывают 0,25 н раствором соли Мора до перехода окраски в устойчивый зеленый цвет. Параллельно проводят опыт с 20 мл дистиллированной воды (контроль). поправку титра раствора соли Мора устанавливают по титрованному раствору бихромата калия или перманганата калия (в трех повторностях). В колбу 100 мл вводят пипеткой 10 мл раствора соли Мора, добавляют 1-2 мл концентрированной серной кислоты, 3-4 капли фенилантраниловой кислоты и титруют титрованным раствором перманганата калия (0,1 н) до бледно-розовой окраски.
Бихроматная окисляемость рассчитывается по формуле:
где
Расчет титра соли Мора:
где 0,1 – нормальность раствора 10 – объем раствора соли Мора, мл. Округление результатов производят в зависимости от величины бихроматной окисляемости.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что показывает величина значения ХПК (БПК)? 2. Известные методы определения ХПК и их особенности. 3. Факторы, влияющие на значение величины ХПК, и их учет либо устранение. 4. Что является сильным окислителем для загрязнений воды? 5. Погрешность методов определения окисляемости.
ТЕХНИКА БЕЗОПАСНОСТИ
1. Все работы с кислотами и окислителями выполняются под тягой. 2. Перед сжиганием (кипячением) проб воды с окислителями проверяется исправность работы водяных холодильников. 3. Каждый реактив забирается соответствующей пипеткой. 4. Перед смешением воды и кислот необходимо проверить целостность стеклянной посуды (вливать кислоту в воду, а не наоборот).
ЛАБОРАТОРНАЯ РАБОТА №4 При взаимодействии ортофосфат-ионов с молибдатом в кислой среде образуется жёлтая гетерополикислота, которая под действием восстановителей превращается в интенсивно окрашенное синее соединение. Восстановление можно проводить оловом или аскорбиновой кислотой. Восстановление аскорбиновой кислотой, сравнительно слабым восстановителем, происходит только при повышенной температуре, т.е. в условиях, когда полифосфат и органические эфиры фосфорной кислоты гидролизуются с образованием ортофосфорной кислоты. Для ускорения реакции при комнатной температуре и интенсификации окраски вводят соль сурьмы (антимонилтартрат калия – КSbH4O6·0,5H2O).
Мешающие вещества. Сильнокислые и сильнощелочные пробы предварительно нейтрализуют. Определению мешают сульфиды и Н2S, в концентрации, превышающих 3 мг/л. Мешающие влиянию можно устранить, прибавляя несколько мг КMnО4 на 100 мл пробы и встряхивая 1-2 мин; раствор должен быть розовым. Затем прибавляют требуемые для определения реактивы, но в обратном порядке: сначала раствор аскорбиновой кислоты, перемешивают и вливают раствор молибтана. Для устранения влияния нитритов вводят сульфаминовой кислоты, которую вводят в состав применяемого реактива. При большом содержании железа следует ввести эквивалентное количество ЭДТА.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Концентрацию фосфатов определяем в питьевой и сточной воде. К 50 мл пробы, профильтрованной в день отбора через мембранный фильтр № 1 или через плотный бумажный фильтр (синяя лента), приливают 2 мл смешанного раствора через короткое время – 0,5 мл раствора аскорбиновой кислоты (в присутствии мешающих веществ, реактивы приливают в обратном порядке). Смесь перемешивают. Одновременно проводят холостое определение с 50 мл дистиллированной воды. Через 15 мин (20 мин.) определяют оптическую плотность. Измерение проводят при
Расчёт. Содержание растворённых неорганических фосфатов (мг/л) ( Х = С×1000/V,
где С – концентрация фосфатов, определённая по калибровочной кривой, мг/л; V – объём пробы, взятой для анализа, мл. В диапазоне концентраций до 1 мг/л результаты округляют до сотых долей мг/л, свыше 1 мг/л – до десятых долей мг/л.
Построение калибровочного графика
Берут 0; 1,0; 2,5; 5,0…..50,0 мл рабочего стандартного раствора 2 фосфата калия, разбавляют каждый раствор до 50 мл дистиллированной Н2О и далее продолжают, как в ходе определения (общее содержание растворённых ортофосфатов, найденных экспериментально, выражают в мг/л Измеряют оптическую плотность и строят график зависимости оптической плотности от концентрации ионов фосфорной кислоты. Таблица 1. Построение калибровочной кривой.
3. ЗАДАНИЕ
1. Построить калибровочную кривую в диапазоне 0-1 мг/л 2. Провести определение фосфата в водопроводной воде (сравнить данные с ГОСТ на воду питьевую). 3. Рассчитать и построить калибровочную кривую на содержание фосфатов до 50 мг/л. 4. Провести определение содержание ПРИЛОЖЕНИЕ Таблица 1 Давление насыщенного водяного пара при температурах от 10 до 39 °С
Таблица 2 Плотность элементов
ЛАБОРАТОРНАЯ РАБОТА №1 РЕАГЕНТНЫЕ СПОСОБЫ РАЗДЕЛЕНИЯ СОЖ
Введение
Коагуляция – процесс слипания частиц в дисперсных системах, ведущий к уменьшению числа частиц дисперсной фазы, снижению их свободной поверхности и к увеличению массы каждой частицы. Особенно эффективно процесс коагуляции проходит в области коллоидной дисперсности, т.е. мельчайших частиц, находящихся во взвешенном состоянии в поле сил тяжести не выпадающих в осадок. Коагуляция в естественных условиях происходит под влиянием молекулярных сил при соударении частиц в результате броуновского движения. Коагуляция ускоряется под действием внешних сил и воздействий: при перемешивании, при градиентном или неравномерном течении, при акустическом воздействии или под действием звуковых волн, вызывающих сближение частиц, при поляризации в электрическом поле. Коагулянты – вещества, способные вызывать или ускорять коагуляцию. При введении в дисперсную систему коагулянтов ускоряется и облегчается отделение частиц дисперсной фазы от сплошной среды. Концентрация коагулянта, при которой наступает быстрая коагуляция, называется порогом коагуляции. Широко распространены полимерные коагулянты – различные растворимые высокомолекулярные соединения. Макромолекулы полимерного поверхностно-активного вещества закрепляются отдельными участками цепи одновременно на двух частицах и таким образом связывают частицы в прочные флокулы, устойчивые к механическому разрушению при перемешивании. Полимерная флокуляция используется в процессах обогащения руд, при водоочистке, в производстве бумаги и в экологических процессах очистки промстоков и хозбытовых сточных вод. Особый случай коагуляции представляет гетерокоагуляция, при которой две дисперсные системы взаимно коагулируют друг друга в результате прилипания частиц одной дисперсной фазы к частицам другой. Обычно это происходит при разноименно заряженной поверхности частиц каждой дисперсной фазы. В этом случае ионо-электростатические силы приводят к притяжению частиц, а не к их отталкиванию. Использование мелкодисперсной золы, извести и других материалов для гетерокоагуляции вместо применения дорогостоящих полимерных коагулянтов более эффективно и экономически целесообразно особенно в экологических процессах. С гетерокоагуляцией связан механизм коагулирующего воздействия солей многовалентных металлов, которые гидролизуются с образованием коллоидного гидрооксида.
Смазочно-охлаждающая жидкость (СОЖ) представляет собой концентрат водосмешиваемой полусинтетической СОЖ на основе минерального масла, органических поверхностно-активных веществ (ПАВ), антифрикционных присадок с ингибиторами коррозии и бактерицидом. СОЖ разработана для использования на металлообрабатывающем оборудовании с циркуляционной подачей технологической подачей технологической среды, на станках специального назначения или на ручных слесарных работах. Концентрация эмульсии зависит от состава технологической операции и обрабатываемого материала. Для обезвреживания отработанной эмульсии СОЖ могут использоваться несколько методов: - Метод ультрафильтрации. - Метод огневого обезвреживания. - Реагентный метод.
Цель работы: Изучение процесса коагуляции и возможности его применения для очистки промышленных сточных вод от тонкодисперсной твердой или жидкой фазы (особенно коллоидных взвесей).
Степень очистки СОЖ определяют фотометрическим методом с помощью каллориметра фотоэлектрического компенсационного КФК-2. Принцип измерения светопропускания состоит в том, что на фотоприемник поочередно направляются потоки – полный (прошедший через дистиллированную воду) и частично поглащенный после прохождения через исследуемую среду и затем определяется их отношение. Концентрацию примесей в пробах находят по градуировочному графику. Для построения градуировочного графика приготавливают серию стандартных растворов (с известным содержанием примесей). Обычно это делают, разбавляя исходную неочищенную жидкость дистиллированной водой в известной пропорции. Измеряются коэффициенты светоп
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 326; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.24.36 (0.011 с.) |

 - кальций
- кальций
 - гидрокарбонат
- гидрокарбонат
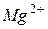 - магний
- магний
 - хлорид
- хлорид
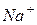 - натрий
- натрий
 - сульфат
- сульфат
 - калий
- калий
 - нитрат
- нитрат
 - аммоний
- аммоний
 - фторид
- фторид
 - железо
- железо
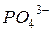 - фосфат
- фосфат
 .
. +
+  ), сульфатные (
), сульфатные ( ). Большинство природных вод имеет величину
). Большинство природных вод имеет величину  ). Различают три вида жесткости: временную, постоянную и общую.
). Различают три вида жесткости: временную, постоянную и общую. и
и  , которые при кипячении переходят в нерастворимые соли (карбонаты кальция и магния) и выпадают в виде плотного осадка (накипи):
, которые при кипячении переходят в нерастворимые соли (карбонаты кальция и магния) и выпадают в виде плотного осадка (накипи):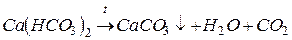

 и
и  , которые выпадают в осадок (уравнения 1 и 2), при этом устраняется временная жесткость воды.
, которые выпадают в осадок (уравнения 1 и 2), при этом устраняется временная жесткость воды.


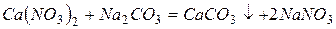
 , способные к обмену на катионы
, способные к обмену на катионы  и
и  солей жесткости, растворенных в воде.
солей жесткости, растворенных в воде.

 - аниониты) на ионы из обрабатываемой воды, после чего необходима их регенерация (восстановление).
- аниониты) на ионы из обрабатываемой воды, после чего необходима их регенерация (восстановление).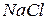 (поваренной соли), либо в
(поваренной соли), либо в  или
или  . Свойства ионообменной смолы анионита восстанавливаются при обработке его 2-4 %
. Свойства ионообменной смолы анионита восстанавливаются при обработке его 2-4 %  .
.

 (в обмен на анион
(в обмен на анион 


 регулируют работой водоструйного насоса и рассчитывают как отношение собранной в емкости 4 воды ко времени сбора. Период сбора воды в емкости контролируют с помощью секундомера.
регулируют работой водоструйного насоса и рассчитывают как отношение собранной в емкости 4 воды ко времени сбора. Период сбора воды в емкости контролируют с помощью секундомера. (мг-экв/л),
(мг-экв/л),
 - нормальность раствора трилона Б;
- нормальность раствора трилона Б; - объем раствора трилона Б, пошедшего на титрование, мл.
- объем раствора трилона Б, пошедшего на титрование, мл. ,
,
 - изменение жесткости воды до и после фильтрования;
- изменение жесткости воды до и после фильтрования; - исходная жесткость воды.
- исходная жесткость воды. ) или бихромат калия (
) или бихромат калия (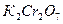 ). Для удобства использования полученных результатов их пересчитывают и представляют в виде количества кислорода эквивалентного израсходованному окислителю. В зависимости от применяемого окислителя различают окисляемость перманганатную, бихроматную и др. Выбор метода определения зависит от количества загрязнений в воде и от их природы (органические или минеральные). Так для анализа питьевой воды и слабо загрязненных поверхностных вод (окисляемость которых не выше 100 мг О2/л) применяют перманганатный метод. Для определения общей окисляемости сильно загрязненных и сточных вод (окисляемость 100 и более мг О2/л) используют бихроматный метод.
). Для удобства использования полученных результатов их пересчитывают и представляют в виде количества кислорода эквивалентного израсходованному окислителю. В зависимости от применяемого окислителя различают окисляемость перманганатную, бихроматную и др. Выбор метода определения зависит от количества загрязнений в воде и от их природы (органические или минеральные). Так для анализа питьевой воды и слабо загрязненных поверхностных вод (окисляемость которых не выше 100 мг О2/л) применяют перманганатный метод. Для определения общей окисляемости сильно загрязненных и сточных вод (окисляемость 100 и более мг О2/л) используют бихроматный метод.
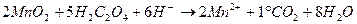
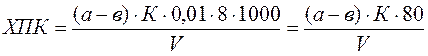 мг О2/л,
мг О2/л, – количество 0,01 н раствора перманганата калия израсходованного на титрование анализируемой пробы, мл;
– количество 0,01 н раствора перманганата калия израсходованного на титрование анализируемой пробы, мл; – количество 0,01 н раствора перманганата калия израсходованного на титрование холостой пробы, мл;
– количество 0,01 н раствора перманганата калия израсходованного на титрование холостой пробы, мл; – поправочный коэффициент для раствора перманганата калия (
– поправочный коэффициент для раствора перманганата калия ( в 1 л, а от 10 до 100 мг
в 1 л, а от 10 до 100 мг  мг О2/л
мг О2/л ,
, ;
; = 800 нм или при максимально возможном для данного прибора значении.
= 800 нм или при максимально возможном для данного прибора значении. ) определяют по формуле:
) определяют по формуле: (табл.1).
(табл.1). , °C
, °C
 , мм.рт.ст.
, мм.рт.ст.



