
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Полевые методы анализа природных водСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Полевой химический анализ воды имеет большое научное и практическое значение. Он помогает: • целесообразно направлять и корректировать гидрогеологические работы в процессе их выполнения; • отбирать наиболее важные пробы для полного анализа; • на месте определять летучие и быстроизменяющиеся компоненты. В полевой анализ воды входит определение не только летучих (СО2, Н2S, О2), быстроизменяющихся (t, pH, Fe2+, NO2-) компонентов, но и определение ионов, характеризующих другие ее важнейшие свойства (Са2+, Mg2+, NH+, Na+, Сl-, SO42-, NO3-, НСО3-, СО32-). Учитывая скорость изменения физических свойств и химического состава, при выполнении полевого анализа воды, соблюдают следующую последовательность определений: 1. температура, рН, запах, прозрачность, цвет; 2. свободная углекислота, сероводород, кислород; 3. нитрат и нитрит ионы, аммоний, железо закисное и окисное; 4. карбонат - и гидрокарбонат-ионы, жесткость, ионы кальция, магния, сульфаты, хлориды и вкус. Во время учебной практики с помощью полевой лаборатории за 20-30 минут можно выполнить анализ воды, состоящий из определений: рН, Fe3+, Fe рН определяют колориметрическим методом с универсальным индикатором Алямовского. Ионы Fe3+, Fe^ (в виде трехвалентного) определяют колориметрическим методом с роданидом калия или аммония. Ион Fe2+ определяют расчетным путем. Ион NH4+ определяют колориметрическим методом с реактивом Несслера. Ион NO2- определяют колориметрическим методом с реактивом Грисса. Ионы НСО3- и СОз2- определяют объемным методом, если рН раствора меньше 8.2, то такая вода не содержит карбонатов. Общую жесткость и Са2+ определяют объемным трилонометрическим методом. Ион Mg2+ рассчитывают по разности. Ион Сl- определяют аргентометрическим капельным методом. Ион SO42" определяют турбидиметрическим методом. Лабораторная работа № 1 ВИЗУАЛЬНАЯ КОЛОРИМЕТРИЯ Цель работы Определение микрокомпонентов (NH4+, NO2-, Fe3+) и концентрации водородных ионов (рН) в природных водах. Общие сведения В визуальных колориметрических методах интенсивность потока излучения оценивается на глаз. Ряд визуальных методов применяется на практике для определения микрокомпонентов (NH4+, NO2-, Fe3+) и концентрации водородных ионов (рН) в природных водах. Используемые в визуальных методах для сравнения интенсивности окраски калиброванные пробирки должны быть одинакового диаметра, высоты и с одинаковой прозрачностью стекла. Для сравнения окраски используют прибор, называемый компаратором. Прибор состоит из деревянного куба, в котором сверху просверлены два круглых вертикальных отверстия для пробирок и с боков - горизонтальные сквозные отверстия, пересекающиеся с первыми, через которые и сравнивают окраски исследуемого раствора без индикатора и с индикатором. Окраски сравнивают по горизонтальному направлению, подложив белый фон и держа пробирки в наклонном положению к фону, используя пленочные шкалы. ОПРЕДЕЛЕНИЕ рН ПРИ ПОМОЩИ РАСТВОРА УНИВЕРСАЛЬНОГО ИНДИКАТОРА Цель работы Определение кислой, нейтральной или щелочной среды природной воды через концентрацию водородных ионов с использованием универсального индикатора Алямовского и стандартных окрашенных пленочных шкал. Общие сведения Водные растворы всегда содержат водородные и гидроксиль-ные ионы. Произведение концентрации водородных и гидроксиль-ных ионов в воде всегда постоянно и зависит только от температуры. Под концентрацией водородных и гидроксильных ионов понимают содержание грамм-эквивалентов соответствующего иона в одном литре раствора. Если реакция водного раствора нейтральна, концентрация водородных и гидроксильных ионов одинакова и равна Обычно кислую, щелочную или нейтральную среду определяют через концентрацию водородных ионов. Для характеристики концентрации водородных ионов пользуются только показателем степени при десяти, отбрасывая отрицательный знак и обозначая символом рН (показатель концентрации водородных ионов). Колориметрический метод определения рН основан на свойстве ряда индикаторов менять свою окраску в зависимости от концентрации ионов водорода, причем для каждого индикатора существуют вполне определенные границы, при которых происходит изменение окраски. В полевых условиях используют универсальный индикатор Алямовского и стандартные окрашенные пленочные шкалы (диапазон измерений рН 4-8.0). Чувствительность этого метода 0.1 рН.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 863; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.248.88 (0.009 с.) |

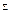 , Fe2+, NO3-, NH4+, Ca2+, Mg2+, Сl-, SO42-, NO3-,HCO3-, CO32-.
, Fe2+, NO3-, NH4+, Ca2+, Mg2+, Сl-, SO42-, NO3-,HCO3-, CO32-. . Для растворов, имеющих кислую реакцию, концентрация водородных ионов будет больше
. Для растворов, имеющих кислую реакцию, концентрация водородных ионов будет больше 


