
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение общей жесткости питьевой водыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы: научиться определять жесткость воды методом комплексонометрического титрования.
Основные теоретические положения Жесткость воды – это свойство природной воды, зависящее от наличия в ней растворенных солей кальция и магния. Суммарное содержание этих солей называют общей жесткостью. Общая жесткость представляет собой сумму карбонатной (временной или устранимой) и некарбонатной (постоянной) жесткости. Карбонатная жесткость обусловлена содержанием в воде гидрокарбонатов и карбонатов (при pH >8,3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды, так как при нагреве воды (точнее, при температуре более 60о) гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок малорастворимых карбонатов Ca(HCO3)2 Mg(HCO3)2 2Mg(HCO3)2 Некарбонатная жесткость обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется. Она устраняется добавлением соды, фосфата натрия, ионообменных смол и других химикатов. В России показатель жесткости выражается в мг-экв./л: 1мг-экв. жесткости соответствует содержанию 20,04 мг ионов кальция и 12,16 мг ионов магния в литре воды. 1 моль/м3 = 1 ммоль/л = 1 мг-экв./л = 1 мг-экв./дм3 Вода с жесткостью менее 4 мг-экв./л считается мягкой, от 4 до 8 мг-экв./л – средней жесткости, от 8 до 12 мг-экв./л – жесткой и более 12 мг-экв./л – очень жесткой. Общая жесткость колеблется от единиц до десятков, иногда сотен мг-экв./л, причем карбонатная жесткость составляет до 70-80 % от общей жесткости. Величина жесткости воды зависит от типа пород и почв, слагающих бассейн водосбора, а также сезона года и погодных условий. Жесткость водоемов не нормируется. Допустимая величина общей жесткости для питьевой воды и источников централизованного водоснабжения составляет не более 7,0 мг-экв./л (в отдельных случаях до 10 мг-экв./л). Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус, оказывает отрицательное действие на органы пищеварения, провоцирует отложение солей в суставах, вызывает заболевания щитовидной железы и нарушение обменных процессов в организме, приводит к образованию шлаков и накипи на поверхности теплообменных аппаратов, повышенному расходу моющих средств, плохому развариванию пищевых продуктов и т.п. Пониженное содержание солей жесткости также опасно и вызывает у населения кариес, ослабление костей скелета и нарушение ритма сердца. В зависимости от уровня pH мягкая вода может оказывать повышенное коррозионное воздействие на водопроводные трубы. Сущность метода Общую жесткость определяют методом комплексонометрического титрования, основанном на образовании прочного комплексного соединения катионов кальция и магния с реактивом - трилоном Б (двунатриевой солью этилендиаминтетрауксусной кислоты – ЭДТА) в щелочной среде (pH 10,0÷10,5) в присутствии индикатора – кислотного хром темно-синего. Определение протекает по схеме Ca2+ + Na2H2R Mg2+ + Na2H2R где R – радикал этилендиаминтетрауксусной кислоты – (-OOCCH2)2NCH2CH2N(CH2COO-)2.
Посуда, реактивы и материалы Мерный цилиндр на 100 мл, пипетки на 10, 25 мл, бюретка на 25 мл, колбы конические на 250÷300 мл, капельница, груша Раствор трилона Б (комплексон III, двунатриевая соль этилендиаминтетрауксусной кислоты) (0,05 н.), раствор буферный аммиачный, pH 10-10,5 (NH4OH + NH4Cl), раствор гидроксиламина солянокислого (1 %), раствор кислоты соляной (0,1 н.), раствор сернистого натрия (сульфида натрия) (5 %), натрий хлористый, раствор сернокислого магния (0,05 н.) или раствор хлористого цинка (0,05 н.), раствор индикатора хромоген черного специального ЕТ-00 или раствор индикатора кислотного хром темно-синего, дистиллированная вода
Порядок выполнения работы 1. Определение поправочного коэффициента к нормальности раствора трилона Б. В коническую колбу вносят 10 мл 0,05 н. раствора хлористого цинка или 10 мл 0,05 н. раствора сернокислого марганца и разбавляют дистиллированной водой до 100 мл. Прибавляют 5 мл буферного раствора, 5÷7 капель индикатора и титруют при сильном взбалтывании раствором трилона Б до изменения окраски в эквивалентной точке. Окраска должна быть синей с фиолетовым оттенком при прибавлении индикатора хрома темно-синего и синей с зеленоватым оттенком при прибавлении индикатора хромогена черного. 2. Определение общей жесткости. Определению общей жесткости воды мешают: медь, цинк, марганец и высокое содержание углекислых и двууглекислых солей. Влияние мешающих веществ устраняется в ходе анализа. В коническую колбу вносят 100 мл охлажденной и отфильтрованной испытуемой воды. Затем прибавляют 5 мл буферного раствора, 5÷7 капель индикатора или 0,1 г сухой смеси индикатора хромоген черного с сухим хлористым натрием и сразу же титруют при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке (окраска должна быть синей с зеленоватым оттенком). Определяют количество раствора, израсходованное на титрование. Если на титрование израсходовано больше 10 мл 0,05 н. раствора трилона Б, то это указывает на то, что в отмеренном объеме воды суммарное содержание ионов кальция и магния больше 0,5 мг·экв. В таких случаях следует определение повторить, взяв меньший объем воды и разбавив его до 100 мл дистиллированной водой. Нечеткое изменение окраски в эквивалентной точке указывает на присутствие меди и цинка. Для устранения их влияния к отмеренной для титрования пробе прибавляют 1÷2 мл раствора сернистого натрия, после чего проводят испытание, как указано выше. Если после прибавления к отмеренному объему воды буферного раствора и индикатора титруем раствор постепенно обесцвечивается, приобретая серый цвет, что указывает на присутствие марганца, то в этом случае к пробе воды, отобранной для титрования, до внесения реактивов, следует прибавить пять капель 1 %-ного раствора солянокислого гидроксиламина и далее определять жесткость, как указано выше. Если титрование приобретает крайне затяжной характер с неустойчивой и нечеткой окраской в эквивалентной точке, что наблюдается при высокой щелочности воды, ее влияние устраняется прибавлением к пробе воды, отобранной для титрования, до внесения реактивов, 0,1 н. раствора соляной кислоты в количестве, необходимом для нейтрализации щелочности воды, с последующим кипячением или продуванием раствора воздухом в течение 5 мин. После этого прибавляют буферный раствор, индикатор и далее определяют жесткость, как указано выше.
Обработка результатов 1. Поправочный коэффициент к нормальности раствора трилона Б вычисляют по формуле
где 10 – количество 0,05 н. раствора хлористого цинка или сернокислого марганца, взятое для анализа, мл; VT – количество раствора трилона Б, израсходованное на титрование, мл. 2. Общую жесткость воды (мг-экв./л) вычисляют по формуле
где VT1 – количество раствора трилона Б, израсходованное на титрование, мл; 0,05 – нормальность раствора трилона Б; K – поправочный коэффициент к нормальности раствора трилона Б; 1000 – коэффициент пересчета единиц измерения; VA – объем пробы воды, взятый на анализ, мл.
Оформление результатов Полученные результаты заносят в таблицу 1.2. Таблица 1.2 Экспериментальные данные
Выводы по данной работе должны содержать: 1) оценку жесткости пробы питьевой воды в отношении влияния на здоровье человека; 2) о пригодности пробы воды для питья; 3) тип жесткости данной пробы воды. Вопросы для самопроверки 1. Что такое жесткость, общая, временная и постоянная жесткость? 2. В каких единицах измеряется жесткость? 3. Какова оптимальная жесткость воды для питья? 4. Последствия применения особо жесткой воды: а) в тепловом хозяйстве; б) в связи с применением в быту; в) при употреблении в пищу? 5. Каким образом можно устранить некарбонатную жесткость? 6. Сущность метода комплексонометрического титрования? Лабораторная работа № 4. Определение цветности воды Цель работы: научиться оценивать цветность воды визуальным и фотометрическим методами.
Основные теоретические положения Чистая вода, наблюдаемая в проходящем свете, на глубине нескольких метров имеет слегка голубоватую окраску. Иные оттенки свидетельствуют о наличии в воде растворенных и взвешенных примесей. Цвет воды – физическое свойство воды, обусловленное наличием ряда примесей. Цвет воды колеблется от слабо-желтоватого до красно-коричневатого. Различают «кажущийся цвет», обусловленный нерастворенными взвешенными веществами, и «истинный цвет», вызванный присутствием в воде растворенных веществ. Цветность – это показатель качества воды, характеризующий интенсивность окраски и обусловленный содержанием окрашенных соединений. Цветность не устраняется при отстаивании и фильтровании воды. Цветность природных вод обусловлена, главным образом, присутствием гумусовых веществ, комплексных соединений железа, некоторых других металлов и водорослей. Интенсивную окраску воды могут создавать сточные воды некоторых предприятий. Цветность воды может зависеть от свойств и структуры дна водоема, характера водной растительности и прилегающих к водоему почв, наличия болот и торфяников в водосборном бассейне и др. Цветность природных вод колеблется от единиц до тысяч градусов. По цветности воды делятся на: малоцветные (до35 градусов), средней цветности (до 80 градусов) и высокоцветные (свыше 80 градусов). Цветность питьевой воды не должна превышать 20 градусов. В отдельных случаях допускается цветность до 35 градусов. Цветность воды определяется по платинокобальтовой шкале и выражается в условных градусах этой шкалы. За единицу цветности принимают цветность раствора, содержащего определенные концентрации хлорплатината калия и хлорида кобальта. При отсутствии вышеуказанных, можно использовать бихромат калия и сульфат кобальта. Высокая цветность свидетельствует о неблагополучии воды. Она ухудшает органолептические свойства, препятствует процессам самоочищения воды и оказывает отрицательное влияние на развитие водных растительных и животных организмов. Цветность можно оценивать качественно, характеризуя цвет воды, и количественно, определяя градус цветности. Цветность воды определяют как визуально (органолептически), так и при помощи фотометра (фотометрически), путем сравнения проб испытуемой воды с растворами стандартной платинокобальтовой шкалы, имитирующими цвет природной воды. Сущность метода заключается в измерении светопоглощения пробы с помощью фотометра. Фотометр предназначен для измерения оптической плотности. При прохождении светового потока через окрашенный раствор, поглощение света зависит от двух факторов – концентрации раствора и толщины слоя, через который проходит световой поток. Эту зависимость выражает закон Бугера-Ламберта-Бера, называемый также объединенным законом светопоглощения:
где Десятичный логарифм отношения интенсивности падающего света и интенсивности света, прошедшего через раствор, называется оптической плотностью раствора. Его обозначают Таким образом, оптическая плотность раствора прямо пропорциональна концентрации раствора и толщине поглощающего слоя.
Приборы, посуда и реактивы Фотометр фотоэлектрический (КФК-3) ( Кюветы с толщиной поглощающего слоя 5÷10 см Цилиндры мерные на 25, 100 мл, цилиндры Несслера на 100 мл, колбы мерные на 1000 мл, колбы конические на 250÷300 мл, пипетки мерные на 1, 5, 10 мл с делениями на 0,1 мл, груша, фильтры «синяя лента» Калий двухромовокислый, кобальт сернокислый, кислота серная плотностью 1,84 г/см3, дистиллированная вода
Подготовка к выполнению работы Изучить инструкцию по работе на фотометре фотоэлектрическом КФК-3.
Порядок выполнения работы 1. Определение цветности органолептически Приготовление шкалы цветности: Раствор № 1: растворяют отдельно в дистиллированной воде 0,0875 г двухромовокислого калия и 2,0 г сернокислого кобальта, затем их смешивают, прибавляют 1 мл концентрированной серной кислоты и доводят объем раствора дистиллированной водой до 1 л. Раствор № 2: 1 мл концентрированной серной кислоты доводят дистиллированной водой до 1л. В цилиндрах Несслера смешивают растворы № 1 и № 2 в соотношении, указанном на шкале цветности (см. табл. 1.3). Таблица 1.3 Стандартная хромово-кобальтовая шкала цветности
Раствор в каждом цилиндре соответствует определенному градусу цветности. Шкалу цветности хранят в темном месте. Через каждые 2÷3 месяца ее заменяют. В цилиндр Несслера отмеривают 50 мл исследуемой воды и сравнивают со шкалой цветности, производя просмотр сверху вниз на белом фоне. Если исследуемая проба воды имеет цветность выше 70 градусов, пробу следует разбавить дистиллированной водой в определенном соотношении до получения окраски исследуемой воды, сравнимой с окраской шкалы цветности. 2. Определение цветности фотометрически Стандартные растворы шкалы цветности поочередно, при помощи мерного цилиндра, помещают в кювету и измеряют величину оптической плотности с помощью фотометра при длине волны 413 нм. Контрольной жидкостью служит дистиллированная вода. По полученным результатам строят градуировочный график зависимости оптической плотности от цветности раствора, откладывая по оси абсцисс цветность в градусах, а по оси ординат – соответствующие им значения оптической плотности. Затем измеряют оптическую плотность исследуемого раствора и по градуировочному графику определяют градус цветности этого раствора. Примечание – На точность измерений большое влияние оказывает чистота рабочих граней кюветы. Поэтому во время работы кювету берут руками только за нерабочие грани, после заполнения ее раствором, следят за отсутствием на стенках даже мельчайших пузырьков воздуха. Перед каждым измерением кювету ополаскивают дистиллированной водой дважды, а рабочие грани и дно тщательно протирают фильтровальной бумагой.
Оформление результатов Полученные результаты заносят в таблицы 1.4 и 1.5. Таблица 1.4 Экспериментальные данные для построения градуировочного графика
Таблица 1.5 Результаты исследований
Вопросы для самопроверки 1. Цвет и цветность воды – определения? 2. Чем обусловлена цветность природной воды? 3. Что принимают за единицу цветности? 4. Какими методами можно определить цветность воды? 5. Как построить градуировочный график? 6. Понятие оптической плотности раствора? От чего она зависит? 7. Закон Бугера-Ламберта-Бера? 8. Что влияет на точность измерений при определении оптической плотности на фотометре? 9. Что служит контрольной жидкостью в данном эксперименте?
Лабораторная работа № 5. Определение запаха воды Цель работы: органолептически дать оценку запаха воды. Основные теоретические положения Химически чистая вода совершенно лишена запаха. В природе такая вода не встречается, она всегда содержит в своем составе растворенные вещества. По мере роста концентрации этих веществ вода начинает приобретать тот или иной запах. Запах – это свойство воды, вызывать у человека специфическое раздражение слизистой оболочки носовых ходов. Он обусловлен наличием в воде летучих пахнущих веществ. На запах воды оказывает влияние: состав содержащихся в ней веществ, температура, значение рН, степень загрязненности водного объекта, биологическая обстановка, гидрологические условия и т. д. Запах воды характеризуется видом запаха и его интенсивностью. Запах оценивают в баллах. Наличие запаха у воды устанавливается органолептически. При этом дается качественная и количественная характеристика. Вначале определяют характер запаха, затем интенсивность. Характер запаха воды определяют субъективно, ощущением воспринимаемого запаха, и выражают описательно. Запах по характеру подразделяют на две группы (см. табл. 1.6): 1) естественного происхождения (обусловлен жизнедеятельностью водных организмов, продуктами их распада, водной растительностью, влиянием почв, берегов, дна водоема); 2) искусственного происхождения (появляется при попадании в воду тех или иных химических веществ, со сточными водами предприятий различных отраслей промышленности, а также при обработке воды различными реагентами и т.д.). Минимальное ощущение запаха определяется пороговой концентрацией вещества, которая колеблется в широких пределах от 0,005 до 0,05 мг/л, в среднем составляя 0,01÷0,1 мг/л.
Таблица 1.6 Шкала характера запаха
Интенсивность запаха оценивают по 5-балльной системе, согласно требованиям (см. табл. 1.7). Таблица 1.7 Шкала интенсивности запаха
Продолжение табл.1.7
Для питьевой воды допускается запах не более 2-х баллов. Количественно интенсивность запаха можно оценить, определяя «пороговое число» запаха N – степень разбавления анализируемой воды водой, лишенной запаха (обработанной активированным углем (0,6 г угля на 1 л воды), либо пропущенной через бытовой фильтр для очистки воды).
где Запах определяют при нормальной (20о С) и повышенной (60о С) температуре воды.
Оборудование, реактивы и материалы Электрическая плитка, термометр, часовое стекло Колбы плоскодонные с притертыми пробками на 250÷300 мл, колбы конические термостойкие на 100 мл Стандартная шкала запахов естественного происхождения Стандартная шкала запахов искусственного происхождения
Порядок выполнения работы При определении запаха воды руководствуются таблицами 1.6 и 1.7. 1. Определение запаха при температуре 20о С Колбу с притертой пробкой наполняют на 1/3 объема исследуемой водой с температурой 20о С. Колбу закрывают пробкой, содержимое колбы несколько раз перемешивают вращательными движениями. После чего колбу открывают и сразу же определяют характер и интенсивность запаха, вдыхая воздух из колбы. Воздух вдыхают осторожно, не допуская глубоких вдохов. 2. Определение запаха при температуре 60о С Термостойкую колбу наполняют на 1/3 исследуемой водой. Горлышко колбы закрывают часовым стеклом и подогревают воду в колбе на электрической плитке до температуры 60о С. Снимают колбу с плитки и содержимое колбы несколько раз перемешивают вращательными движениями. Сдвигая стекло в сторону, быстро определяют характер и интенсивность запаха.
Оформление результатов Полученные результаты заносят в таблицу 1.8. Таблица 1.8 Результаты исследований
Вопросы для самопроверки 1. Дать определение запаха воды? 2. Чем обусловлен запах воды? 3. С помощью каких характеристик можно оценить запах воды количественно и качественно? 4. Виды запахов? 5. Что такое «пороговое число» запаха? 6. Чем определяется минимальное ощущение запаха? 7. Как можно определить характер и интенсивность запаха? 8. Какие свойства воды ухудшает запах? 9. Норматив по запаху для питья?
Лабораторная работа № 6.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 6351; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.90.108 (0.01 с.) |

 CaCO3
CaCO3  + CO2
+ CO2  +H2O
+H2O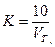
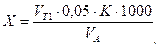
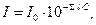 откуда
откуда 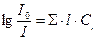
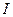 - интенсивность светового потока, прошедшего через раствор;
- интенсивность светового потока, прошедшего через раствор; 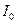 - интенсивность светового потока, попадающего на раствор;
- интенсивность светового потока, попадающего на раствор;  - молярный коэффициент светопоглощения, л×г-моль-1 ×см-1; l – толщина поглощающего свет раствора (длина оптического пути), см; С – концентрация окрашенного вещества в растворе, г-моль/л.
- молярный коэффициент светопоглощения, л×г-моль-1 ×см-1; l – толщина поглощающего свет раствора (длина оптического пути), см; С – концентрация окрашенного вещества в растворе, г-моль/л. .
.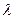 - 413 нм)
- 413 нм)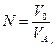
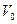 - суммарный объем воды (с запахом и без запаха), мл;
- суммарный объем воды (с запахом и без запаха), мл;  - объем анализируемой воды (с запахом), мл.
- объем анализируемой воды (с запахом), мл.


