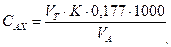Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение остаточного активного хлораСодержание книги
Поиск на нашем сайте В водопроводной воде Цель работы:научиться определять концентрацию остаточного активного хлора в водопроводной воде.
Основные теоретические положения Хлор может существовать в воде в составе хлоридов и таких соединений как: свободный хлор (Cl2), гипохлорит-анион (ClO-), хлорноватистая кислота (HСlO), хлорамины (монохлорамин NH2Cl, дихлорамин NHCl2, трихлорид азота NCl3). Суммарное содержание этих соединений называют термином «активный хлор». Активный хлор существует в двух формах: свободный хлор и связанный хлор. Свободный хлор – хлор, присутствующий в воде в виде хлорноватистой кислоты, иона гипохлорита или растворенного элементарного хлора. Связанный хлор – хлор, присутствующий в воде в виде хлораминов. Общий хлор – сумма свободного и связанного хлора. Хлорамины – производные аммиака, образованные замещением одного, двух или трех атомов водорода атомами хлора. Соединения, содержащие активный хлор используют для обеззараживания (дезинфекции) питьевой воды и воды в бассейнах, химической очистки некоторых сточных вод, ликвидации очагов распространения инфекционных загрязнений (например, хлорная известь). Наиболее широко для дезинфекции питьевой воды используют свободный хлор, который при растворении в воде диспропорционирует по реакции Cl2 +H2O = H+ + Cl- + HOCl Эффект действия хлора на микроорганизмы зависит от начальной дозы хлора, продолжительности сохранения его воде и pH воды. Хлор расходуется на окисление примесей органического и неорганического происхождения. При выборе дезинфицирующего вещества следует учитывать содержание в нем «активного хлора». «Активным» называют количество молекулярного хлора, отвечающее окислительной способности данного соединения относительно йодистого калия в кислой среде. Понятие «активный хлор» определяет не истинное содержание хлора в соединении, а окислительную способность соединения в кислой среде по йодистому калию. В природной воде содержание «активного хлора» не допускается; в питьевой воде его предельно-допустимая концентрация (ПДК) установлена в пересчете на хлор, на уровне 0,3-0,5 мг/л в свободном виде и на уровне 0,8-1,2 мг/л в связанном виде. «Активный хлор» присутствует в питьевой воде не более нескольких десятков минут и нацело удаляется даже при кратковременном кипячении воды. По этой причине анализ отобранной пробы на содержание активного хлора следует производить немедленно. Сущность метода Активный хлор определяется йодометрическим методом (методом йодометрического титрования). Метод основан, на свойстве всех содержащих активный хлор соединений в кислой среде, выделять из йодида калия свободный йод Cl2 + 2I- = I2 + 2Cl- ClO- + 2H+ + 2I- = I2 + Cl- + H2O HClO + H+ + 2I- = I2 + Cl- + H2O NH2Cl + 2H+ + 2I- = I2 + NH4+ + Cl- Свободный йод оттитровывают раствором тиосульфата натрия в присутствии крахмала, который добавляют для более точного определения точки эквивалентности. Озон, нитриты, окись железа и другие соединения в кислом растворе выделяют йод из йодистого калия, поэтому пробы воды подкисляют буферным раствором с pH 4,5. Йодометрический метод предназначен для анализа воды с содержанием активного хлора более 0,3 мг/л. Метод может использоваться для анализа мутных и окрашенных вод.
Посуда, реактивы Колба коническая с пробкой на 250 мл, мерный цилиндр на 100 мл, бюретка на 25 мл, микробюретка на 5 мл, пипетки на 1мл, воронка Раствор буферный ацетатный (pH 4,5), калий йодистый в кристаллах, раствор тиосульфата натрия (натрий серноватистокислый) (0,01 н. и 0,005 н.), раствор калия двухромовокислого (0,01 н.), кислота серная (25 %), раствор крахмала (0,5 %), дистиллированная вода
Порядок выполнения работы 1. Определение поправочного коэффициента В коническую колбу помещают 0,5 г йодистого калия, растворяют в 2 мл дистиллированной воды, прибавляют 5 мл серной кислоты (25 %), затем 10 мл 0,01 н. раствора двухромовокислого калия, добавляют 80 мл дистиллированной воды, закрывают колбу пробкой, перемешивают и ставят в темное место на 5 мин. Выделившийся йод титруют тиосульфатом натрия в присутствии 1 мл крахмала, прибавленного в конце титрования. 2. Определение остаточного активного хлора В коническую колбу насыпают 0,5 г йодистого калия, растворяют его в 1-2 мл дистиллированной воды, затем добавляют 1 мл буферного раствора, после чего добавляют 250 мл анализируемой воды. Выделившийся йод оттитровывают 0,005 н. раствором тиосульфата натрия из микробюретки до появления светло-желтой окраски, после чего прибавляют 1 мл 0,5 %-ного раствора крахмала и раствор титруют до исчезновения синей окраски. По делениям микробюретки определяют общий объем тиосульфата, израсходованный на титрование (как до, так и после добавления крахмала).
Обработка результатов 1. Поправочный коэффициент (0,01; 0,005 н. растворов серноватистокислого натрия) вычисляют по формуле
где 2. Концентрацию остаточного активного хлора (мг/л) вычисляют по формуле
где VT – количество 0,005 н. раствора тиосульфата натрия, израсходованное на титрование, мл; K – поправочный коэффициент нормальности раствора тиосульфата натрия; 0,177 – содержание активного хлора в мг, соответствующее 1 мл 0,005 н. раствора тиосульфата; 1000 – коэффициент пересчета единиц измерения из миллилитров в литры; VA – объем пробы воды, взятый для анализа, мл.
Оформление результатов Полученные результаты заносят в таблицу 1.1. Таблица 1.1 Экспериментальные данные
Вопросы для самопроверки 1. Для чего необходимо хлорировать воду? 2. В составе каких соединений может присутствовать хлор в воде? 3. Что такое «активный» хлор, «свободный» и «связанный» хлор? 4. Сущность метода йодометрического титрования при определении «активного» хлора? 5. Предельно-допустимая концентрация «активного» хлора в питьевой воде? 6. Допускается ли содержание «активного» хлора в природной воде? 7. Почему анализ отобранной пробы на содержание «активного» хлора следует проводить немедленно?
Лабораторная работа № 2.
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 4926; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.005 с.) |

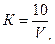
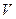 – количество серноватистокислого натрия, израсходованное на титрование, мл.
– количество серноватистокислого натрия, израсходованное на титрование, мл.