
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение водородного показателя (рН)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы: научиться определять величину рН водных растворов электрометрическим методом.
Основные теоретические положения Вода состоит из молекул. Молекула воды относится к слабым электролитам. Степень ее диссоциации невелика. То есть сохраняется равновесие
Это равновесие определяется законом действия масс:
Так как степень диссоциации воды невелика, то концентрацию молекул воды можно считать величиной постоянной и равной 55,4. Тогда
Величина Так, при t=25оС Пользуясь ионным произведением воды можно дать характеристику любой реакции среды (кислой, нейтральной, щелочной) с помощью концентрации водородных ионов. Величину, характеризующую концентрацию свободных (активных) ионов водорода в воде, называют водородным показателем – рН. Численно он равен показателю степени концентрации водородных ионов, взятому с противоположным знаком, т.е. например, если Концентрацию водородных ионов выражают в виде их десятичных логарифмов, взятых с обратным знаком:
Чаще всего концентрация водородных ионов оценивается в г-ион/л. Значения величины рН определяют в интервале от 1 до 14. Поскольку шкала рН логарифмическая, то изменение рН на единицу, соответствует десятикратному изменению концентрации ионов Н+. Величина рН природной воды определяется: 1) количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды: если если если 2) соотношением концентраций угольной кислоты и ее ионов:
Величина рН в природных водах зависит от содержания в них карбонатов, присутствия органических кислот, растворенных газов, деятельности микроорганизмов, солей, подверженных гидролизу, состава пород слагающих водосборный бассейн. Изменения рН тесно связаны с процессами фотосинтеза (при потреблении CO2 водной растительностью высвобождаются ионы ОН-) и распада органических веществ. Пониженные значения рН свидетельствуют о закислении водного объекта. Причинами закисления могут быть как природные, так и антропогенные факторы. Природные факторы: 1) кислотные дожди (при извержении вулканов выделяются оксиды серы; при разряде молнии выделяются оксиды азота); 2) гумусовые кислоты, присутствующие в кислых почвах, перегное лесной подстилки; 3) деятельность микроорганизмов, разрушающих органические соединения и восстанавливающих серу в сероводород (H2S); 4) гидролиз солей тяжелых металлов (при окислении сульфидов получаются сульфаты железа, меди, свинца, алюминия и др., которые расщепляются)
Антропогенные факторы: 1) сбросы недостаточно очищенных сточных вод; 2) кислотные дожди, образующиеся при взаимодействии оксидов серы и азота с атмосферной влагой (парами) от сжигания угля, сланцев, бензина, нефти и т. д. Величина рН воды – один из важнейших показателей качества воды. Она имеет большое значение для химических и биологических процессов, происходящих в природных водах. От величины рН зависит развитие и жизнедеятельность водных растений и организмов, степень коррозийной агрессивности воды на металлы и бетон. Величина рН влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ. Этот показатель важен при обработке питьевой воды, подготовке воды для промышленных установок, при утилизации бытовых и заводских стоков. Контроль за уровнем рН ведется на всех стадиях водоочистки. У пунктов питьевого водопользования, в водах водоемов рыбохозяйственного назначения величина рН не должна выходить за пределы интервала значений 6,5÷8,5. Для определения рН используют рН-метрию (электрометрический метод) и визуальную колориметрию. Визуально-колориметрическое определение проводят с использованием портативных тест-комплектов, основанных на реакции индикатора с водородными ионами, сопровождающейся изменением окраски раствора. Точность измерения с помощью тест-комплектов – около 0,5 единиц рН. Этот метод недостаточно точен, требует введения солевых и температурных поправок, дает значительную погрешность при определении величины рН в мутных и окрашенных растворах. Электрометрический метод предполагает измерение водородного показателя с помощью стационарных приборов – рН-метров. Измерения проводятся с точностью от 0,1 до 0,02 единиц рН. Он позволяет проводить исследования практически в любой воде, независимо от ее окраски, мутности и солевого состава. Электрометрический метод основан на измерении э.д.с. электрохимической ячейки, состоящей из пробы воды, измерительного и вспомогательного электродов. В качестве измерительного (индикаторного) электрода используется стеклянный мембранный электрод, а в качестве вспомогательного (электрода) – проточный хлорсеребряный электрод. Электродная система при погружении в контролируемый раствор развивает э.д.с. Э.д.с., возникающая между электродами равна алгебраической разности между их потенциалами. Потенциал электрода сравнения постоянен и не зависит от активности ионов водорода. Потенциал другого электрода представляет собой разность потенциалов, возникающих на границах между внешней поверхностью стеклянной мембраны и исследуемым раствором, с одной стороны, и внутренней поверхностью мембраны и стандартным раствором кислоты, с другой. Поскольку внутренний стандартный раствор стеклянного электрода имеет постоянную активность ионов водорода, потенциал на внутренней поверхности мембраны не изменяется и измеряемая разность потенциалов определяется потенциалом, возникающим на границе между внешней поверхностью стеклянного электрода и исследуемым раствором. Э.д.с. линейно зависит от активности ионов водорода и температуры раствора. С помощью высокоомного измерительного преобразователя э.д.с. электродной системы преобразуется и считывается с индикатора рН-метра. Влияние температуры компенсируется с помощью термокомпенсатора. Прибор рН-метр проверяют и настраивают по буферным растворам.
Приборы, посуда и материалы Иономер универсальный ЭВ-74, стеклянный электрод ЭСЛ-63-07, проточный хлорсеребряный электрод ЭВЛ-1МЗ, термокомпенсатор ТКА-5 Стакан на 50 мл, фильтровальная бумага, дистиллированная вода
Подготовка к выполнению работы Изучить инструкцию по работе на иономере.
Порядок выполнения работы Перед погружением в раствор электроды промывают дистиллированной водой и удаляют остатки воды фильтровальной бумагой. Затем погружают их в стаканчик с исследуемой пробой и через 3 минуты снимают показания с показывающего прибора.
Оформление результатов Полученные результаты заносят в таблицу 1.11. Таблица 1.11 Результаты исследований
Вопросы для самопроверки 1. Какую величину называют водородным показателем? 2. Как выражают концентрацию водородных ионов? 3. Соотношением каких ионов определяется величина рН? 4. Единицы измерения концентрации водородных ионов? 5. От чего зависит величина рН в природной воде? 6. С какими процессами связаны изменения величины рН? 7. Причины закисления водного объекта? 8. Подвержена ли концентрация ионов водорода сезонным колебаниям? 9. Каким способом можно измерить величину рН цветных растворов и суспензий? 10. В чем заключается электрометрический метод определения рН? 11. Чему равен потенциал индикаторного электрода? 12. Как зависит э.д.с. электродной системы от активности водородных ионов? 13. Норматив по рН для питьевого и рыбохозяйственного назначения? 14. По каким растворам проверяют и настраивают рН-метры?
Лабораторная работа № 8.
|
||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 1165; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.01 с.) |



 .
. .
. - называется ионным произведением воды и является величиной постоянной при определенной температуре для любых концентраций водородных и гидроксид-ионов в растворе.
- называется ионным произведением воды и является величиной постоянной при определенной температуре для любых концентраций водородных и гидроксид-ионов в растворе. (г-ион/л)2, а при t=100оС
(г-ион/л)2, а при t=100оС 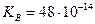 (г-ион/л)2.
(г-ион/л)2. , то рН=7.
, то рН=7. .
. , то раствор нейтральный и рН=7;
, то раствор нейтральный и рН=7; ,
,  , то раствор кислый и рН<7;
, то раствор кислый и рН<7;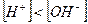 ,
, 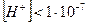 , то раствор щелочной и рН>7;
, то раствор щелочной и рН>7;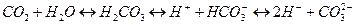 .
. .
.


