
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
К выполнению лабораторных работ и практическихСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте ЭКОЛОГИЯ Методические указания К выполнению лабораторных работ и практических заданий по дисциплине «Экология»
Братск 2007 УДК 574 (075.8) Экология: Методические указания к выполнению лабораторных работ и практических заданий по дисциплине «Экология» / М.Р. Ерофеева, И.В. Камышникова. - Братск: ГОУ ВПО «БрГУ», 2007. - 92 с.
Содержат лабораторные работы, практические задания, перечень вопросов к зачету, а также тестовый контроль знаний и задания для самостоятельной работы Предназначены для бакалавров и специалистов инженерно-технических специальностей «БрГУ» Рецензент: Юшков Н.Н, кандидат медицинских наук, начальник управления охраны окружающей среды Администрации г. Братска.
Печатается по решению издательско-библиотечного совета
Содержание
Введение
Целью изучения дисциплины «Экология» является формирование у студентов экологического мировоззрения и способности к оценке своей профессиональной деятельности с точки зрения сохранения окружающей среды. Поэтому основная задача дисциплины – обучение будущего специалиста производства грамотному восприятию явлений, связанных с жизнью человека в природной среде. В результате изучения «Экологии» студент должен знать: - концептуальные основы экологии; - общие черты современного экологического кризиса и пути выхода из него; - экологические принципы рационального природопользования; - основы инженерно-технологических мероприятий по защите биосферы; экономический механизм охраны окружающей среды, а также основы государственного и международного законодательства в области природопользования и охраны окружающей среды.
Рекомендации к выполнению лабораторных работ В лабораторном практикуме студенты ознакомятся с приемами определения основных показателей качества воды, методами ее очистки и правилами обработки результатов. Целью лабораторного практикума является приобретение определенных навыков при оценке качества питьевой и природной воды на соответствие нормативным характеристикам (ПДК) и определении загрязненности сточных вод в процессе их очистки. Эта задача может быть успешно решена только в том случае, если лабораторные работы выполняются с достаточным пониманием сущности способов и методов определения. Поэтому подготовка к выполнению лабораторной работы является одним из важнейших этапов. Для выполнения лабораторных работ студентам выдаются необходимые методические указания, необходимые справочные и нормативные материалы, а также инструкции по работе на приборах.
Подготовка к работе При подготовке к работе рекомендуется придерживаться следующего плана. 1. Прочитайте название работы, основные теоретические положения и порядок выполнения работы от начала до конца. Выясните смысл всех непонятных слов. Задача первого прочтения состоит в том, чтобы выяснить, что изучается в данной работе и каким методом проводится исследование. 2. Ознакомьтесь с принципом работы приборов, которые предлагается использовать в работе. 3. Разберите формулы, выясните, какие величины и с какой точностью будут определяться, каковы их размерности. 4. Начертите в лабораторном журнале таблицы, в которые будут заноситься экспериментальные данные или результаты исследований. 5. Продумайте, какой окончательный результат должен быть получен в данной лабораторной работе. Студенты допускаются к выполнению работы после проверки знаний в объеме вопросов для самопроверки.
Выполнение работы При выполнении работы вначале следует ознакомиться с приборами или лабораторными установками, используемыми в работе. Нужно установить их соответствие описанию, выполнить рекомендованную в описании, последовательность действий по подготовке прибора к работе. После проведенной подготовки, можно приступить к измерениям. Все записи при выполнении лабораторной работы должны вестись исключительно в лабораторном журнале. В нем производятся прикидочные расчеты и записываются предварительные результаты.
Требования к оформлению отчета 1. На титульном листе указывается номер и название работы. 2. В начале отчета формулируется цель или задачи работы. 3. Небольшое теоретическое введение в работу, вскрывающее суть работы. 4. Оборудование, материалы и реактивы, используемые для проведения работы. 5. Схема установки (прибора). 6. Таблицы непосредственных измерений или экспериментальных данных, причем все таблицы должны быть озаглавлены, например, «Таблица 1. Результаты измерения цветности воды». 7. Расчетные формулы, как в символьном виде, так и с подставленными числами. 8. Графики. 9. Выводы. В выводах должны быть проанализированы полученные результаты и дано заключение об их связи с теоретическими зависимостями. 10. Отчет по работе выполняется на листах формата А 4. 11. Полностью оформленный отчет и теоретический материал сдается преподавателю. Лабораторная работа №1. В водопроводной воде Цель работы:научиться определять концентрацию остаточного активного хлора в водопроводной воде.
Основные теоретические положения Хлор может существовать в воде в составе хлоридов и таких соединений как: свободный хлор (Cl2), гипохлорит-анион (ClO-), хлорноватистая кислота (HСlO), хлорамины (монохлорамин NH2Cl, дихлорамин NHCl2, трихлорид азота NCl3). Суммарное содержание этих соединений называют термином «активный хлор». Активный хлор существует в двух формах: свободный хлор и связанный хлор. Свободный хлор – хлор, присутствующий в воде в виде хлорноватистой кислоты, иона гипохлорита или растворенного элементарного хлора. Связанный хлор – хлор, присутствующий в воде в виде хлораминов. Общий хлор – сумма свободного и связанного хлора. Хлорамины – производные аммиака, образованные замещением одного, двух или трех атомов водорода атомами хлора. Соединения, содержащие активный хлор используют для обеззараживания (дезинфекции) питьевой воды и воды в бассейнах, химической очистки некоторых сточных вод, ликвидации очагов распространения инфекционных загрязнений (например, хлорная известь). Наиболее широко для дезинфекции питьевой воды используют свободный хлор, который при растворении в воде диспропорционирует по реакции Cl2 +H2O = H+ + Cl- + HOCl Эффект действия хлора на микроорганизмы зависит от начальной дозы хлора, продолжительности сохранения его воде и pH воды. Хлор расходуется на окисление примесей органического и неорганического происхождения. При выборе дезинфицирующего вещества следует учитывать содержание в нем «активного хлора». «Активным» называют количество молекулярного хлора, отвечающее окислительной способности данного соединения относительно йодистого калия в кислой среде. Понятие «активный хлор» определяет не истинное содержание хлора в соединении, а окислительную способность соединения в кислой среде по йодистому калию. В природной воде содержание «активного хлора» не допускается; в питьевой воде его предельно-допустимая концентрация (ПДК) установлена в пересчете на хлор, на уровне 0,3-0,5 мг/л в свободном виде и на уровне 0,8-1,2 мг/л в связанном виде. «Активный хлор» присутствует в питьевой воде не более нескольких десятков минут и нацело удаляется даже при кратковременном кипячении воды. По этой причине анализ отобранной пробы на содержание активного хлора следует производить немедленно. Сущность метода Активный хлор определяется йодометрическим методом (методом йодометрического титрования). Метод основан, на свойстве всех содержащих активный хлор соединений в кислой среде, выделять из йодида калия свободный йод Cl2 + 2I- = I2 + 2Cl- ClO- + 2H+ + 2I- = I2 + Cl- + H2O HClO + H+ + 2I- = I2 + Cl- + H2O NH2Cl + 2H+ + 2I- = I2 + NH4+ + Cl- Свободный йод оттитровывают раствором тиосульфата натрия в присутствии крахмала, который добавляют для более точного определения точки эквивалентности. Озон, нитриты, окись железа и другие соединения в кислом растворе выделяют йод из йодистого калия, поэтому пробы воды подкисляют буферным раствором с pH 4,5. Йодометрический метод предназначен для анализа воды с содержанием активного хлора более 0,3 мг/л. Метод может использоваться для анализа мутных и окрашенных вод.
Посуда, реактивы Колба коническая с пробкой на 250 мл, мерный цилиндр на 100 мл, бюретка на 25 мл, микробюретка на 5 мл, пипетки на 1мл, воронка Раствор буферный ацетатный (pH 4,5), калий йодистый в кристаллах, раствор тиосульфата натрия (натрий серноватистокислый) (0,01 н. и 0,005 н.), раствор калия двухромовокислого (0,01 н.), кислота серная (25 %), раствор крахмала (0,5 %), дистиллированная вода
Порядок выполнения работы 1. Определение поправочного коэффициента В коническую колбу помещают 0,5 г йодистого калия, растворяют в 2 мл дистиллированной воды, прибавляют 5 мл серной кислоты (25 %), затем 10 мл 0,01 н. раствора двухромовокислого калия, добавляют 80 мл дистиллированной воды, закрывают колбу пробкой, перемешивают и ставят в темное место на 5 мин. Выделившийся йод титруют тиосульфатом натрия в присутствии 1 мл крахмала, прибавленного в конце титрования. 2. Определение остаточного активного хлора В коническую колбу насыпают 0,5 г йодистого калия, растворяют его в 1-2 мл дистиллированной воды, затем добавляют 1 мл буферного раствора, после чего добавляют 250 мл анализируемой воды. Выделившийся йод оттитровывают 0,005 н. раствором тиосульфата натрия из микробюретки до появления светло-желтой окраски, после чего прибавляют 1 мл 0,5 %-ного раствора крахмала и раствор титруют до исчезновения синей окраски. По делениям микробюретки определяют общий объем тиосульфата, израсходованный на титрование (как до, так и после добавления крахмала).
Обработка результатов 1. Поправочный коэффициент (0,01; 0,005 н. растворов серноватистокислого натрия) вычисляют по формуле
где 2. Концентрацию остаточного активного хлора (мг/л) вычисляют по формуле
где VT – количество 0,005 н. раствора тиосульфата натрия, израсходованное на титрование, мл; K – поправочный коэффициент нормальности раствора тиосульфата натрия; 0,177 – содержание активного хлора в мг, соответствующее 1 мл 0,005 н. раствора тиосульфата; 1000 – коэффициент пересчета единиц измерения из миллилитров в литры; VA – объем пробы воды, взятый для анализа, мл.
Оформление результатов Полученные результаты заносят в таблицу 1.1. Таблица 1.1 Экспериментальные данные
Вопросы для самопроверки 1. Для чего необходимо хлорировать воду? 2. В составе каких соединений может присутствовать хлор в воде? 3. Что такое «активный» хлор, «свободный» и «связанный» хлор? 4. Сущность метода йодометрического титрования при определении «активного» хлора? 5. Предельно-допустимая концентрация «активного» хлора в питьевой воде? 6. Допускается ли содержание «активного» хлора в природной воде? 7. Почему анализ отобранной пробы на содержание «активного» хлора следует проводить немедленно?
Лабораторная работа № 2. Лабораторная работа №3. Лабораторная работа № 4. Определение цветности воды Цель работы: научиться оценивать цветность воды визуальным и фотометрическим методами.
Основные теоретические положения Чистая вода, наблюдаемая в проходящем свете, на глубине нескольких метров имеет слегка голубоватую окраску. Иные оттенки свидетельствуют о наличии в воде растворенных и взвешенных примесей. Цвет воды – физическое свойство воды, обусловленное наличием ряда примесей. Цвет воды колеблется от слабо-желтоватого до красно-коричневатого. Различают «кажущийся цвет», обусловленный нерастворенными взвешенными веществами, и «истинный цвет», вызванный присутствием в воде растворенных веществ. Цветность – это показатель качества воды, характеризующий интенсивность окраски и обусловленный содержанием окрашенных соединений. Цветность не устраняется при отстаивании и фильтровании воды. Цветность природных вод обусловлена, главным образом, присутствием гумусовых веществ, комплексных соединений железа, некоторых других металлов и водорослей. Интенсивную окраску воды могут создавать сточные воды некоторых предприятий. Цветность воды может зависеть от свойств и структуры дна водоема, характера водной растительности и прилегающих к водоему почв, наличия болот и торфяников в водосборном бассейне и др. Цветность природных вод колеблется от единиц до тысяч градусов. По цветности воды делятся на: малоцветные (до35 градусов), средней цветности (до 80 градусов) и высокоцветные (свыше 80 градусов). Цветность питьевой воды не должна превышать 20 градусов. В отдельных случаях допускается цветность до 35 градусов. Цветность воды определяется по платинокобальтовой шкале и выражается в условных градусах этой шкалы. За единицу цветности принимают цветность раствора, содержащего определенные концентрации хлорплатината калия и хлорида кобальта. При отсутствии вышеуказанных, можно использовать бихромат калия и сульфат кобальта. Высокая цветность свидетельствует о неблагополучии воды. Она ухудшает органолептические свойства, препятствует процессам самоочищения воды и оказывает отрицательное влияние на развитие водных растительных и животных организмов. Цветность можно оценивать качественно, характеризуя цвет воды, и количественно, определяя градус цветности. Цветность воды определяют как визуально (органолептически), так и при помощи фотометра (фотометрически), путем сравнения проб испытуемой воды с растворами стандартной платинокобальтовой шкалы, имитирующими цвет природной воды. Сущность метода заключается в измерении светопоглощения пробы с помощью фотометра. Фотометр предназначен для измерения оптической плотности. При прохождении светового потока через окрашенный раствор, поглощение света зависит от двух факторов – концентрации раствора и толщины слоя, через который проходит световой поток. Эту зависимость выражает закон Бугера-Ламберта-Бера, называемый также объединенным законом светопоглощения:
где Десятичный логарифм отношения интенсивности падающего света и интенсивности света, прошедшего через раствор, называется оптической плотностью раствора. Его обозначают Таким образом, оптическая плотность раствора прямо пропорциональна концентрации раствора и толщине поглощающего слоя.
Приборы, посуда и реактивы Фотометр фотоэлектрический (КФК-3) ( Кюветы с толщиной поглощающего слоя 5÷10 см Цилиндры мерные на 25, 100 мл, цилиндры Несслера на 100 мл, колбы мерные на 1000 мл, колбы конические на 250÷300 мл, пипетки мерные на 1, 5, 10 мл с делениями на 0,1 мл, груша, фильтры «синяя лента» Калий двухромовокислый, кобальт сернокислый, кислота серная плотностью 1,84 г/см3, дистиллированная вода
Подготовка к выполнению работы Изучить инструкцию по работе на фотометре фотоэлектрическом КФК-3.
Порядок выполнения работы 1. Определение цветности органолептически Приготовление шкалы цветности: Раствор № 1: растворяют отдельно в дистиллированной воде 0,0875 г двухромовокислого калия и 2,0 г сернокислого кобальта, затем их смешивают, прибавляют 1 мл концентрированной серной кислоты и доводят объем раствора дистиллированной водой до 1 л. Раствор № 2: 1 мл концентрированной серной кислоты доводят дистиллированной водой до 1л. В цилиндрах Несслера смешивают растворы № 1 и № 2 в соотношении, указанном на шкале цветности (см. табл. 1.3). Таблица 1.3 Стандартная хромово-кобальтовая шкала цветности
Раствор в каждом цилиндре соответствует определенному градусу цветности. Шкалу цветности хранят в темном месте. Через каждые 2÷3 месяца ее заменяют. В цилиндр Несслера отмеривают 50 мл исследуемой воды и сравнивают со шкалой цветности, производя просмотр сверху вниз на белом фоне. Если исследуемая проба воды имеет цветность выше 70 градусов, пробу следует разбавить дистиллированной водой в определенном соотношении до получения окраски исследуемой воды, сравнимой с окраской шкалы цветности. 2. Определение цветности фотометрически Стандартные растворы шкалы цветности поочередно, при помощи мерного цилиндра, помещают в кювету и измеряют величину оптической плотности с помощью фотометра при длине волны 413 нм. Контрольной жидкостью служит дистиллированная вода. По полученным результатам строят градуировочный график зависимости оптической плотности от цветности раствора, откладывая по оси абсцисс цветность в градусах, а по оси ординат – соответствующие им значения оптической плотности. Затем измеряют оптическую плотность исследуемого раствора и по градуировочному графику определяют градус цветности этого раствора. Примечание – На точность измерений большое влияние оказывает чистота рабочих граней кюветы. Поэтому во время работы кювету берут руками только за нерабочие грани, после заполнения ее раствором, следят за отсутствием на стенках даже мельчайших пузырьков воздуха. Перед каждым измерением кювету ополаскивают дистиллированной водой дважды, а рабочие грани и дно тщательно протирают фильтровальной бумагой.
Оформление результатов Полученные результаты заносят в таблицы 1.4 и 1.5. Таблица 1.4 Экспериментальные данные для построения градуировочного графика
Таблица 1.5 Результаты исследований
Вопросы для самопроверки 1. Цвет и цветность воды – определения? 2. Чем обусловлена цветность природной воды? 3. Что принимают за единицу цветности? 4. Какими методами можно определить цветность воды? 5. Как построить градуировочный график? 6. Понятие оптической плотности раствора? От чего она зависит? 7. Закон Бугера-Ламберта-Бера? 8. Что влияет на точность измерений при определении оптической плотности на фотометре? 9. Что служит контрольной жидкостью в данном эксперименте?
Лабораторная работа № 5. Определение запаха воды Цель работы: органолептически дать оценку запаха воды. Основные теоретические положения Химически чистая вода совершенно лишена запаха. В природе такая вода не встречается, она всегда содержит в своем составе растворенные вещества. По мере роста концентрации этих веществ вода начинает приобретать тот или иной запах. Запах – это свойство воды, вызывать у человека специфическое раздражение слизистой оболочки носовых ходов. Он обусловлен наличием в воде летучих пахнущих веществ. На запах воды оказывает влияние: состав содержащихся в ней веществ, температура, значение рН, степень загрязненности водного объекта, биологическая обстановка, гидрологические условия и т. д. Запах воды характеризуется видом запаха и его интенсивностью. Запах оценивают в баллах. Наличие запаха у воды устанавливается органолептически. При этом дается качественная и количественная характеристика. Вначале определяют характер запаха, затем интенсивность. Характер запаха воды определяют субъективно, ощущением воспринимаемого запаха, и выражают описательно. Запах по характеру подразделяют на две группы (см. табл. 1.6): 1) естественного происхождения (обусловлен жизнедеятельностью водных организмов, продуктами их распада, водной растительностью, влиянием почв, берегов, дна водоема); 2) искусственного происхождения (появляется при попадании в воду тех или иных химических веществ, со сточными водами предприятий различных отраслей промышленности, а также при обработке воды различными реагентами и т.д.). Минимальное ощущение запаха определяется пороговой концентрацией вещества, которая колеблется в широких пределах от 0,005 до 0,05 мг/л, в среднем составляя 0,01÷0,1 мг/л.
Таблица 1.6 Шкала характера запаха
Интенсивность запаха оценивают по 5-балльной системе, согласно требованиям (см. табл. 1.7). Таблица 1.7 Шкала интенсивности запаха
Продолжение табл.1.7
Для питьевой воды допускается запах не более 2-х баллов. Количественно интенсивность запаха можно оценить, определяя «пороговое число» запаха N – степень разбавления анализируемой воды водой, лишенной запаха (обработанной активированным углем (0,6 г угля на 1 л воды), либо пропущенной через бытовой фильтр для очистки воды).
где Запах определяют при нормальной (20о С) и повышенной (60о С) температуре воды.
Оборудование, реактивы и материалы Электрическая плитка, термометр, часовое стекло Колбы плоскодонные с притертыми пробками на 250÷300 мл, колбы конические термостойкие на 100 мл Стандартная шкала запахов естественного происхождения Стандартная шкала запахов искусственного происхождения
Порядок выполнения работы При определении запаха воды руководствуются таблицами 1.6 и 1.7. 1. Определение запаха при температуре 20о С Колбу с притертой пробкой наполняют на 1/3 объема исследуемой водой с температурой 20о С. Колбу закрывают пробкой, содержимое колбы несколько раз перемешивают вращательными движениями. После чего колбу открывают и сразу же определяют характер и интенсивность запаха, вдыхая воздух из колбы. Воздух вдыхают осторожно, не допуская глубоких вдохов. 2. Определение запаха при температуре 60о С Термостойкую колбу наполняют на 1/3 исследуемой водой. Горлышко колбы закрывают часовым стеклом и подогревают воду в колбе на электрической плитке до температуры 60о С. Снимают колбу с плитки и содержимое колбы несколько раз перемешивают вращательными движениями. Сдвигая стекло в сторону, быстро определяют характер и интенсивность запаха.
Оформление результатов Полученные результаты заносят в таблицу 1.8. Таблица 1.8 Результаты исследований
Вопросы для самопроверки 1. Дать определение запаха воды? 2. Чем обусловлен запах воды? 3. С помощью каких характеристик можно оценить запах воды количественно и качественно? 4. Виды запахов? 5. Что такое «пороговое число» запаха? 6. Чем определяется минимальное ощущение запаха? 7. Как можно определить характер и интенсивность запаха? 8. Какие свойства воды ухудшает запах? 9. Норматив по запаху для питья?
Лабораторная работа № 6. Йодометрическим методом Цель работы: научиться определять содержание растворенного кислорода в воде водоемов.
Основные теоретические положения Кислород постоянно присутствует в растворенном виде в поверхностных водах. Количество растворенного кислорода в воде характеризует кислородный режим водоема и имеет большое значение для оценки его состояния. Снижение кислорода в воде указывает на ее химическое и/или биологическое загрязнение. Кислород необходим для дыхания гидробионтов и процессов самоочищения водоемов. Процессы, увеличивающие концентрацию кислорода: поглощение кислорода из атмосферы; выделение кислорода водной растительностью в процессе фотосинтеза; поступление в водоемы с дождевыми и снеговыми водами. Процессы, уменьшающие концентрацию кислорода: потребление кислорода различными организмами; брожение, гниение органических остатков; реакции окисления; выделение кислорода из поверхностных слоев. Концентрация растворенного кислорода зависит от температуры, атмосферного давления, степени перемешивания воды, количества осадков, минерализации воды и др. Растворимость кислорода возрастает с уменьшением температуры и минерализации и с увеличением атмосферного давления. Содержание кислорода в поверхностных водах варьирует в пределах от 0 до 14 мг/л и подвержено сезонным и суточным колебаниям. Концентрация растворенного кислорода у пунктов питьевого и санитарного водопользования в пробе, отобранной до 12 часов дня, не должна быть ниже 4 мг/л в любой период года; для водоемов рыбохозяйственного назначения – не ниже 4 мг/л в зимний период (при ледоставе) и 6 мг/л – в летний. Определение концентрации растворенного кислорода проводится методом йодометрического титрования – методом Винклера. Сущность метода Метод Винклера основан на способности гидроксида марганца (II) окисляться в щелочной среде, количественно связывая при этом растворенный в воде кислород, до соединений марганца (IV) Mn2+ + 2OH- = Mn(OH)2 2Mn(OH)2 + O2 = 2MnO(OH)2 и затем в кислой среде снова переходить в двухвалентные соединения, окисляя при этом эквивалентное связанному кислороду, количество ионов йода MnO(OH)2 + 2I- + 4H- = Mn2+ + I2 + 3H2O Выделившийся йод определяется титрованием тиосульфатом натрия с крахмалом, в качестве индикатора I2 + 2S2O32- = 2I- + S4O62- В ходе анализа определяют степень насыщения воды кислородом по отношению к равновесному содержанию при данных температуре и атмосферном давлении. Степень насыщения кислородом это относительное содержание кислорода в воде, выраженное в процентах его нормального содержания. Для поверхностных вод нормальной считается степень насыщения не менее 75 %.
Посуда, реактивы и материалы Бюретка на 25 мл, пипетки градуированные на 1, 2 и 10 мл, пипетка Мора на 5 мл, цилиндр мерный на 100 мл, колбы конические на 250 мл, кислородные склянки с притертыми пробками на 100÷200 мл, воронки, тарелка, сифон, груша Раствор марганца хлористого или сернокислого 4-х водный, раствор едкого натра с калием йодистым, кислота серная (25 %), раствор тиосульфата натрия (0,02 н.), раствор бихромата калия (0,02 н.), раствор крахмала (0,5 %), калий йодистый в кристаллах, дистиллированная вода
Порядок выполнения работы 1. Определение точной концентрации раствора тиосульфата натрия Ввиду неустойчивости 0,02 н. раствора тиосульфата натрия необходимо определять его концентрацию перед началом титрования. В коническую колбу вносят 1 г сухого йодида калия, 80÷90 мл дистиллированной воды, 10 мл раствора серной кислоты (25 %) и 10 мл стандартного раствора бихромата калия. Раствор перемешивают, выдерживают 1÷5 минут в темном месте и титруют пробу раствором тиосульфата натрия до появления слабо-желтой окраски. Затем прибавляют 1 мл раствора крахмала и продолжают титровать, до исчезновения синей окраски. Производят отсчет по бюретке, определяя объем тиосульфата натрия, израсходованного на титрование. 2. Определение содержания растворенного в воде кислорода Наполняют кислородную склянку исследуемой водой, при помощи сифона, до краев. Сразу же фиксируют кислород. Для чего в склянку с пробой воды вводят, отдельными пипетками, 1 мл (при вместимости склянки до 150 мл) или 2 мл (при вместимости склянки более 150 мл) раствора хлористого или сернокислого марганца и 1 или 2 мл щелочного раствора йодистого калия. Пипетки с вводимыми реактивами погружают до половины высоты склянки и по мере выливания поднимают вверх. После введения реактивов склянку закрывают пробкой так, чтобы в ней не оставалось пузырьков воздуха, и содержимое тщательно перемешивают 15÷20 кратным переворачиванием склянки до равномерного распределения осадка в воде. Склянку с зафиксированной пробой помещают в темное место для отстаивания (не менее 10 минут, но не более 24 часов). После того, как отстоявшийся осадок будет занимать менее половины высоты склянки, к пробе приливают 5 или 10 мл (в зависимости от вместимости склянки) раствора серной кислоты, погружая при этом пипетку не касаясь и не взмучивая, осадка и медленно поднимая ее вверх по мере опорожнения. Склянку закрывают пробкой, и содержимое перемешивают до полного растворения осадка. Содержимое склянки полностью переносят в коническую колбу и титруют стандартным раствором тиосульфата натрия до тех пор, пока раствор не станет светло-желтым. Затем прибавляют 1 мл раствора крахмала и продолжают титрование до исчезновения синей окраски. Выждав 30 с, производят отсчет по бюретке, определяя при этом общий объем тиосульфата натрия, израсходованный на титрование (как до, так и после добавления раствора крахмала).
Обработка результатов 1. Точную концентрацию раствора тиосульфата натрия (моль-экв./л) вычисляют по формуле
где CT – молярная концентрация эквивалента раствора тиосульфата натрия, моль-экв./л; СД - молярная концентрация эквивалента раствора дихромата калия, моль-экв./л; VД – объем раствора дихромата калия, взятый для анализа, мл;
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 541; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.023 с.) |

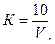
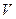 – количество серноватистокислого натрия, израсходованное на титрование, мл.
– количество серноватистокислого натрия, израсходованное на титрование, мл.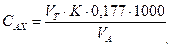
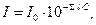 откуда
откуда 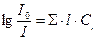
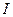 - интенсивность светового потока, прошедшего через раствор;
- интенсивность светового потока, прошедшего через раствор; 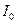 - интенсивность светового потока, попадающего на раствор;
- интенсивность светового потока, попадающего на раствор;  - молярный коэффициент светопоглощения, л×г-моль-1 ×см-1; l – толщина поглощающего свет раствора (длина оптического пути), см; С – концентрация окрашенного вещества в растворе, г-моль/л.
- молярный коэффициент светопоглощения, л×г-моль-1 ×см-1; l – толщина поглощающего свет раствора (длина оптического пути), см; С – концентрация окрашенного вещества в растворе, г-моль/л. .
. - 413 нм)
- 413 нм)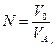
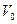 - суммарный объем воды (с запахом и без запаха), мл;
- суммарный объем воды (с запахом и без запаха), мл;  - объем анализируемой воды (с запахом), мл.
- объем анализируемой воды (с запахом), мл.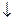

 - объем раствора тиосульфата натрия, израсходованный на титр
- объем раствора тиосульфата натрия, израсходованный на титр 


