
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение содержания растворенного кислородаСодержание книги
Поиск на нашем сайте Йодометрическим методом Цель работы: научиться определять содержание растворенного кислорода в воде водоемов.
Основные теоретические положения Кислород постоянно присутствует в растворенном виде в поверхностных водах. Количество растворенного кислорода в воде характеризует кислородный режим водоема и имеет большое значение для оценки его состояния. Снижение кислорода в воде указывает на ее химическое и/или биологическое загрязнение. Кислород необходим для дыхания гидробионтов и процессов самоочищения водоемов. Процессы, увеличивающие концентрацию кислорода: поглощение кислорода из атмосферы; выделение кислорода водной растительностью в процессе фотосинтеза; поступление в водоемы с дождевыми и снеговыми водами. Процессы, уменьшающие концентрацию кислорода: потребление кислорода различными организмами; брожение, гниение органических остатков; реакции окисления; выделение кислорода из поверхностных слоев. Концентрация растворенного кислорода зависит от температуры, атмосферного давления, степени перемешивания воды, количества осадков, минерализации воды и др. Растворимость кислорода возрастает с уменьшением температуры и минерализации и с увеличением атмосферного давления. Содержание кислорода в поверхностных водах варьирует в пределах от 0 до 14 мг/л и подвержено сезонным и суточным колебаниям. Концентрация растворенного кислорода у пунктов питьевого и санитарного водопользования в пробе, отобранной до 12 часов дня, не должна быть ниже 4 мг/л в любой период года; для водоемов рыбохозяйственного назначения – не ниже 4 мг/л в зимний период (при ледоставе) и 6 мг/л – в летний. Определение концентрации растворенного кислорода проводится методом йодометрического титрования – методом Винклера. Сущность метода Метод Винклера основан на способности гидроксида марганца (II) окисляться в щелочной среде, количественно связывая при этом растворенный в воде кислород, до соединений марганца (IV) Mn2+ + 2OH- = Mn(OH)2 2Mn(OH)2 + O2 = 2MnO(OH)2 и затем в кислой среде снова переходить в двухвалентные соединения, окисляя при этом эквивалентное связанному кислороду, количество ионов йода MnO(OH)2 + 2I- + 4H- = Mn2+ + I2 + 3H2O Выделившийся йод определяется титрованием тиосульфатом натрия с крахмалом, в качестве индикатора I2 + 2S2O32- = 2I- + S4O62- В ходе анализа определяют степень насыщения воды кислородом по отношению к равновесному содержанию при данных температуре и атмосферном давлении. Степень насыщения кислородом это относительное содержание кислорода в воде, выраженное в процентах его нормального содержания. Для поверхностных вод нормальной считается степень насыщения не менее 75 %.
Посуда, реактивы и материалы Бюретка на 25 мл, пипетки градуированные на 1, 2 и 10 мл, пипетка Мора на 5 мл, цилиндр мерный на 100 мл, колбы конические на 250 мл, кислородные склянки с притертыми пробками на 100÷200 мл, воронки, тарелка, сифон, груша Раствор марганца хлористого или сернокислого 4-х водный, раствор едкого натра с калием йодистым, кислота серная (25 %), раствор тиосульфата натрия (0,02 н.), раствор бихромата калия (0,02 н.), раствор крахмала (0,5 %), калий йодистый в кристаллах, дистиллированная вода
Порядок выполнения работы 1. Определение точной концентрации раствора тиосульфата натрия Ввиду неустойчивости 0,02 н. раствора тиосульфата натрия необходимо определять его концентрацию перед началом титрования. В коническую колбу вносят 1 г сухого йодида калия, 80÷90 мл дистиллированной воды, 10 мл раствора серной кислоты (25 %) и 10 мл стандартного раствора бихромата калия. Раствор перемешивают, выдерживают 1÷5 минут в темном месте и титруют пробу раствором тиосульфата натрия до появления слабо-желтой окраски. Затем прибавляют 1 мл раствора крахмала и продолжают титровать, до исчезновения синей окраски. Производят отсчет по бюретке, определяя объем тиосульфата натрия, израсходованного на титрование. 2. Определение содержания растворенного в воде кислорода Наполняют кислородную склянку исследуемой водой, при помощи сифона, до краев. Сразу же фиксируют кислород. Для чего в склянку с пробой воды вводят, отдельными пипетками, 1 мл (при вместимости склянки до 150 мл) или 2 мл (при вместимости склянки более 150 мл) раствора хлористого или сернокислого марганца и 1 или 2 мл щелочного раствора йодистого калия. Пипетки с вводимыми реактивами погружают до половины высоты склянки и по мере выливания поднимают вверх. После введения реактивов склянку закрывают пробкой так, чтобы в ней не оставалось пузырьков воздуха, и содержимое тщательно перемешивают 15÷20 кратным переворачиванием склянки до равномерного распределения осадка в воде. Склянку с зафиксированной пробой помещают в темное место для отстаивания (не менее 10 минут, но не более 24 часов). После того, как отстоявшийся осадок будет занимать менее половины высоты склянки, к пробе приливают 5 или 10 мл (в зависимости от вместимости склянки) раствора серной кислоты, погружая при этом пипетку не касаясь и не взмучивая, осадка и медленно поднимая ее вверх по мере опорожнения. Склянку закрывают пробкой, и содержимое перемешивают до полного растворения осадка. Содержимое склянки полностью переносят в коническую колбу и титруют стандартным раствором тиосульфата натрия до тех пор, пока раствор не станет светло-желтым. Затем прибавляют 1 мл раствора крахмала и продолжают титрование до исчезновения синей окраски. Выждав 30 с, производят отсчет по бюретке, определяя при этом общий объем тиосульфата натрия, израсходованный на титрование (как до, так и после добавления раствора крахмала).
Обработка результатов 1. Точную концентрацию раствора тиосульфата натрия (моль-экв./л) вычисляют по формуле
где CT – молярная концентрация эквивалента раствора тиосульфата натрия, моль-экв./л; СД - молярная концентрация эквивалента раствора дихромата калия, моль-экв./л; VД – объем раствора дихромата калия, взятый для анализа, мл; 2. Содержание растворенного кислорода в воде (мг/л) вычисляют по формуле
где 8 – молярная масса моль-эквивалента кислорода, соответствующая 1 мл 1 нормального раствора тиосульфата натрия; CT – молярная концентрация эквивалента раствора тиосульфата натрия, моль-экв./л; VT –общий объем тиосульфата натрия, израсходованный на титрование, мл; 1000 – пересчет единиц измерения (из граммов в миллиграммы); V – внутренний объем склянки с закрытой пробкой, мл; V1 – суммарный объем растворов, добавленных в склянку при фиксации кислорода, мл. 3. Степень насыщения воды кислородом (%) вычисляют по формуле
где X – концентрация растворенного кислорода в воде, мг/л; 100 – коэффициент пересчета единиц измерения (из мг/л в %); 760 – нормальное атмосферное давление, мм рт. ст.; СН – нормальная концентрация кислорода при температуре в момент отбора пробы и атмосферном давлении 760 мм рт. ст. (приведена в табл. П.1.1); Р – фактическая величина атмосферного давления в момент отбора пробы, мм рт. ст.
Оформление результатов Полученные результаты заносят в таблицы 1.9. и 1.10. Таблица 1.9 Экспериментальные данные
Таблица1.10 Результаты исследований
Вопросы для самопроверки 1. Каким образом кислород попадает в водоем? 2. Перечислите процессы, уменьшающие концентрацию растворенного кислорода в воде? 3. ПДК по растворенному кислороду у пунктов питьевого и санитарного водопользования? 4. О чем свидетельствует снижение кислорода в воде? 5. Как зависит количество растворенного кислорода в воде от температуры? 6. Сущность метода йодометрического титрования? 7. Что такое фиксация кислорода? Лабораторная работа № 7.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 2164; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.009 с.) |

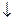

 - объем раствора тиосульфата натрия, израсходованный на титрование, мл.
- объем раствора тиосульфата натрия, израсходованный на титрование, мл.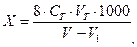
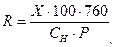
 ,
мл
,
мл
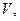 мл
мл
 ,
мл
,
мл
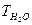 ,
оС
,
оС
 ,
мг/л
,
мг/л



