
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Естественнонаучных направлений и специальностейСодержание книги
Поиск на нашем сайте
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «СЫКТЫВКАРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ХИМИЧЕСКИЙ ПРАКТИКУМ. МЕТОДИЧЕСКИЕ УКАЗАНИЯ ДЛЯ СТУДЕНТОВ ЕСТЕСТВЕННОНАУЧНЫХ НАПРАВЛЕНИЙ И СПЕЦИАЛЬНОСТЕЙ
Составители: к.х.н., доцент Грищенко Н.В. преподаватель Рочева Т.К. преподаватель Старцева О.М.
Сыктывкар 2014 Оглавление 1. Введение. 4 2. Правила работы в химической лаборатории. Техника безопасности. 4 Требования к оформлению отчетов по лабораторным работам.. 4 3. Тема 1. Растворы. Классификация растворов. Способы выражения состава растворов. Приготовление растворов: по точной навеске, из фиксанала. Разбавление и концентрирование растворов. 8 Лабораторная работа № 1. 21 Приготовление разбавленного раствора хлорида натрия из его концентрированного раствора путем разбавления. Контроль состава раствора методом денсиметрии. 21 4. Тема 2. Введение в объемный (титриметрический) анализ. Основные понятия и определения. Классификация методов объемного анализа. Метод нейтрализации. Индикаторы в методе нейтрализации. 25 Лабораторная работа №2. 31 2.1 Алкалиметрическое определение серной кислоты в растворе с индикаторами фенолфталеином и метилоранжем.. 31 2.2 Ацидиметрическое определение карбоната натрия в водном растворе с индикаторами фенолфталеином и метилоранжем.. 34 5. Тема 3. Равновесия в растворах слабых электролитов, кислых и гидролизующихся солей 38 6. Тема 4. Теория кислот и оснований Аррениуса и Бренстеда-Лоури. Сопряженные кислотно-основные пары. Буферные системы.. 48 Лабораторная работа №3. 57 Приготовление буферного раствора заданного состава и исследование его свойств 57 7. Тема 5. Гетерогенные равновесия и процессы.. 60 Лабораторная работа № 4. 65 4.1. Изучение свойств растворов гидролизующихся солей. 65 4.2. Изучение равновесий осадок малорастворимого электролита – его насыщенный раствор 67 8. Тема 6. Окислительно-восстановительные реакции и процессы. Окислительно-восстановительное титрование. Индикаторы в методе окислительно-восстановительного титрования 69 Лабораторная работа № 5. 70 9. Тема 7. Реакции комплексообразования в методах объемного анализа. Комплексоны. Комплексонометрия. Индикаторы в методе комплексонометрии, требования к ним.. 75 Лабораторная работа №6. 83 Комплексонометрическое определение общей жесткости воды.. 83 6.1 Определение общей жесткости водопроводной воды.. 84 6.2 Определение временной жесткости водопроводной воды.. 84 6.3 Определение общей и временной жесткости минеральной воды.. 85 10. Тема 8. Физико-химические основы поверхностных явлений. Сорбция и ее виды. Поверхностно-активные вещества. 86 Лабораторная работа № 7. 90 Изучение адсорбции уксусной кислоты из водного раствора на активированном угле. 90 11. Тема 9. Физикохимия дисперсных систем. Классификация дисперсных систем. Лиофобные коллоидные системы (золи), их получение, свойства. Коагуляция золей электролитами. Правило Шульце-Гарди. 93 Лабораторная работа №8. 94 Экспериментальная проверка правила Шульце-Гарди. 94 ПРИЛОЖЕНИЕ. 95 (Справочные материалы) 95
Введение Преподавание дисциплины «Химия» осуществляется по принципу сочетания теоретической подготовки с выполнением лабораторного практикума как наиболее оптимальному алгоритму усвоения естественнонаучной дисциплины. В конечном счете, студент должен овладеть не только знаниями в области химии, но и практическими навыками. Очевидно, что выполнение лабораторных работ является необходимым средством приобретения практических навыков. В практикум включены классические методы аналитической химии, которые, с одной стороны, на конкретных примерах способны подтвердить фундаментальные законы, лежащие в основе теоретического курса, с другой – помочь приобрести навыки обращения с химическим оборудованием и реактивами, физико-химической аппаратурой. Необходимость освоения классического титриметрического анализа вызвана тем, что его методы принадлежат к числу повседневных процедур, используемых для оценки кислотно-основного состояния и водно-электролитного обмена, для оценки окислительно-восстановительных свойств исследуемых объектов, при контроле окружающей среды и т. д. Лабораторные работы тесно увязаны с соответствующими разделами теоретического курса. Практикум построен таким образом, что каждая его тема включает в себя минимальные сведения из теоретического курса, необходимые для выполнения работы, изложение порядка выполнения практической работы, требования к ее оформлению, набор задач для самостоятельной работы с типичными примерами разбора некоторых из них. Приводится отдельное описание назначения и правил работы с химической аналитической посудой, что обеспечивает быстрое овладение простейшими навыками работы в химической лаборатории. Таким образом, практикум способствует приобретению необходимых навыков лабораторного эксперимента уже на начальной стадии обучения - с постановкой задачи, получением количественных характеристик эксперимента, их последующей статистической обработкой, представлением полученных результатов в различных формах, с глубоким итоговым осмыслением. Это позволит успешно освоить современные методы инструментального анализа, глубокое знание которых необходимо современному квалифицированному специалисту естественнонаучного направления. 2. Правила работы в химической лаборатории. Техника безопасности. Требования к оформлению отчетов по лабораторным работам Цель занятия: 1. Ознакомление с правилами работы в химической лаборатории; проведение инструктажа по технике безопасности. 2. Ознакомление с организацией дисциплины «Химия», реализацией теоретического курса, практических и лабораторных занятий. Требования к выполнению лабораторных работ, ведению лабораторного журнала, составлению отчетности. Значение темы. Работа в химической лаборатории никогда не относилась к категории безопасных. История науки со времен средневековых алхимиков и до наших дней изобилует примерами тяжелых несчастных случаев, нередко с человеческими жертвами из-за взрывов, пожаров в лаборатории. Современная химия немыслима без широкого использования электроэнергии, агрессивных и токсичных соединений, большинство из которых обладает взрыво- или пожароопасными свойствами. Обязанности дежурного: 1. Перед началом занятий проверить готовность доски к началу занятий (мел, тряпка), контролировать наличие дистиллированной воды в емкостях, при необходимости наполнять их. 2. По окончании занятия проверить рабочие места студентов. 3. Стереть записи с доски. 4. Сдать химическую лабораторию лаборанту. Обязанности студентов: 1. Иметь постоянное место в лаборатории. 2. Поддерживать чистоту, порядок на рабочем месте и в лаборатории. 3. Использованные приборы и реактивы возвращать на свои места. 4. Выполнять ту работу, которая указана в инструкции. 5. Беречь электроэнергию, приборы, посуду, реактивы. 6. Сухие реактивы отбирать чистыми, сухими шпателем, пробиркой, ложечкой. 7. Брать при этом минимальное количество реактивов, если в описании не указано, сколько: – сухого вещества в количестве, закрывающем дно пробирки; – раствора не более 1/6 объема пробирки. 8. Держать склянку этикеткой к ладони, наливая из нее раствор. 9. Отверстие нагреваемого сосуда направлять в сторону от себя и от товарища. 10. Смешивая концентрированную кислоту с водой, лить кислоту в воду, а не наоборот. 11. После использования склянку с реактивом закрыть пробкой и поставить на место. 12. Работы, связанные с выделением вредных газов или дыма, выполнять в вытяжном шкафу при включенной вентиляции. 13. Быть осторожным при работе с концентрированными кислотами, щелочами, горючими и легковоспламеняющимися жидкостями. 14. Не оставлять без присмотра работающие приборы, газовые горелки. 15. Окончив работу, вымыть с мылом руки, посуду. 16. Записать результаты лабораторной работы в тетрадь, указав дату, название и цель работы, индивидуальное задание, краткое содержание (теоретическое обоснование), уравнения химических реакций, расчетные формулы, расчеты, рисунки, графики, выводы по работе. По результатам проделанной работы составить отчет согласно прилагаемой методике, защитить его. 17. Сдать рабочее место дежурному. Студент должен знать: местоположение в лаборатории: аптечки, огнетушителя, ящика с песком, мойки, корзины для мусора, рубильника. В лаборатории запрещается: – принимать пищу, курить, громко разговаривать; – находиться без халата; – сливать в раковину растворы кислот, щелочей, солей ртути, серебра, органические жидкости; – выбрасывать остатки химических веществ, фильтры, спички, стеклянный бой в раковину; – ставить на тетради и инструкции (бумажные носители) склянки с реактивами; – зажигать спиртовку от другой спиртовки; – пользоваться реактивами без этикеток на банках (склянках) или с сомнительными надписями на них; – засасывать жидкости в пипетки ртом; – сливать излишки реактива обратно в банку (склянку); – отбирать аликвотные части растворов с использованием пипетки из общей банки (склянки); – ставить пробки от реактивов нижней частью на стол; – пробовать реактивы на вкус.
ОБУЧАЮЩИЕ ЗАДАЧИ Расчеты при приготовлении раствора заданного состава, его разбавлении, концентрировании, смешивании растворов одного и того же вещества объединяет одна общая идея – во всех случаях записывают уравнения материального баланса, связывающие характеристики конечного раствора и его исходных составляющих. В результате получают систему из двух алгебраических уравнений, решая которую, определяют искомые величины, необходимые для приготовления раствора с заданными характеристиками. В расчетах с использованием массовой доли w (А) основу составляют два закона сохранения масс – относительно массы раствора (смеси) и относительно массы растворенного вещества, составленные на основе характеристик составных частей I и II, а также самого раствора (смеси): 1) баланс по массе раствора (смеси): mр-ра(I) + mр-ра(II) = m(р-ра) (или m(смеси)) 2) баланс по массе растворенного вещества А: mA(I) + mA(II) = mA(р-р) (или mA(смеси)) Далее величины, представленные в этих уравнениях, выражают согласно условию задачи через объемы, плотности и массовые доли растворенного вещества соответствующих растворов I и II (соответствующих компонентов I и II) раствора. Следует отметить, что закон сохранения объема при смешивании растворов в общем виде не выполняется, то есть объем смеси не всегда равен сумме объемов исходных растворов. В расчетах с использованием молярной концентрации с(А) основу составляют закон сохранения количества растворенного вещества и приближенно выполняющийся закон сохранения объема раствора (смеси) в случае разбавления и смешения растворов. Последний выполняется тем точнее, чем более разбавлены смешиваемые растворы: 1) баланс по объему смеси при разбавлении и смешивании: Vр-ра(I) + Vр-ра(II) = Vсмеси 2) баланс по количеству растворенного вещества: nА(I) + nА(II) = nА(смеси) или сА(I)Vр-ра(I) + сА(II)Vр-ра(II) = сА(смесь)V(смесь) Пример 1. Какие количества составных частей I и II необходимо взять для приготовления 220 см3 раствора хлорида кальция с w (CaCl2)= 8 %, плотность раствора r = 1,066 г/мл. Рассмотреть следующие способы приготовления раствора: а) m(CaCl2)(тв) и V(H2O) – растворение CaCl2(тв) в воде; б) m(CaCl2·6H2O) и V(H2O) – растворение кристаллогидрата CaCl2·6H2O в воде; в) m (CaCl2)(тв) + Vр-ра с w (СaCl2) =2 % и r =1,015 г/см3 – концентрирование раствора г) Vр-ра с w (СaCl2) =25 % и r =1,228 г/см3 и V(Н2О) – разбавление концентрированного раствора; д) Vр-ра с w (СaCl2) =25 % и r =1,228 г/см3 и Vр-ра с w (СaCl2)= 2 % и r =1,015 г/см3 – смешивание двух растворов; е) Vр-ра с w (СaCl2)= 2 % и r =1,015 г/см3 Решение. а) Составим два балансовых уравнения 1)по массе раствора: m (CaCl2) + m (Н2О) = m (р-ра) = V·r 2)по массе растворенного вещества: M (CaCl2) = V·r·w (СaCl2) Подставляем данные из условия задачи и получаем систему двух уравнений: m (CaCl2) + m (Н2О) = 220 см3 ·1,066 г/см3 =234,52 г m (CaCl2) = 220 см3 ·1,066 г/см3 ·0,08=18,76 г Отсюда m (H2O)= 234,52 г – 18,76 г = 215,76 г Ответ: для приготовления раствора необходимо 18,76 г CaCl2(тв) и 215,76 см3 Н2О (при условии, что r =1 г/см3). б) Рассуждая подобным образом: 1) Уравнение материального баланса по массе раствора: m (CaCl2·6Н2О) + m (Н2О) = m (р-ра) = V·r 2) Уравнение материального баланса по массе вещества CaCl2 в растворе: m (CaCl2/ CaCl2· 6H2O) = V·r·w (СaCl2), где m (CaCl2/CaCl2· 6H2O) = Система уравнений принимает вид: m(CaCl2· 6H2O) + m(Н2О) = m(р-ра) = V·r
подставляем данные из условия задачи: m (CaCl2· 6H2O) + m(Н2О) = 220 см3 ·1,066 г/см3 =234,52 г
Отсюда m (CaCl2· 6H2O) = и m (H2O) = 234,52 г – 37,01 г = 197,51 г Ответ: для приготовления раствора необходимо 37,01 г CaCl2· 6H2O и 197,51 см3 H2O. в) Составим два балансовых уравнения: 1) по массе раствора: m (CaCl2) + m1 = mр-ра или m (CaCl2) + V1r1 = Vr 2) по массе растворенного вещества: m (CaCl2) + m (CaCl2/исх.р-р) = m (CaCl2/конечн.р-р) или m(CaCl2) + V1· r1· w1 = V·r·w Подставляем данные из условия задачи: m (CaCl2) + V1 ·1,015 г/см3 = 220 см3 ·1,066 г/см3 = 234,52 г m (CaCl2) + V1· 1,015 г/см3 ·0,02 = 220 см3 ·1,066 г/см3 ·0,08 =18,76 г Решая систему двух уравнений методом вычитания из первого уравнения второго, получаем: V1· 1,015 г/см3 ·(1-0,02) = 234,52 г -18,76 г = 215,76 г и V1 = m (CaCl2) = 234,52 г -216,91 см3 ·1,015 г/см3 = 14,35 г Ответ: для приготовления раствора нужно 14,35 г CaCl2 и 216,91 см3 исходного раствора с w (CaCl2)= 2 %
г) Составим два балансовых уравнения: 1) по массе раствора V1 ·r1 + m (H2O) = V·r 2) по массе растворенного вещества V1·r1·w1 = V·r·w получим систему: V1·r1 + m (H2O) = V·r V1·r1·w1 = V·r·w подставляем данные из условия задачи: V1 · 1,228 г/см3 + m(H2O) = 220 см3 ·1,066 г/ см3 =234,52 г V1 ·1,228 г/см3 ·0,25 = 220 см3 ·1,066 г/см3 ·0,08=18,76 г Отсюда m (H2O)= 234,52 г – (61,11 см3 ∙ 1,228 г/см3) =159,48 г Ответ: для приготовления раствора необходимо 61,11 см3 исходного раствора с w(CaCl2)= 25 % и 159,48 см3 H2O д) Составим два балансовых уравнения: 1)-по массе раствора V1r1 + V2r2= V·r 2)-по массе растворенного вещества V1 ·r1 ·w1+ V2 ·r2 ·w2 = V·r·w Подставляем данные из условия задачи: V1 ·1,228 г/см3 +V2 ·1,015 г/см3 = 220 см3 ·1,066 г/см3 =234,52 г V1 ·1,228 г/см3 ·0,25 + V2 ·1,015 г/см3 ·0,02 = 220 см3 ·1,066 г/см3 ·0,08=18,76 г Решая систему двух уравнений с двумя неизвестными, находим V1 =49,81 см3 и V2 =170,79 см3. Ответ: для приготовления смешанного раствора необходимо 49,81 см3 раствора с w (CaCl2) =25 % и 170,79 см3 раствора с w (CaCl2) =2 %. е) При выпаривании раствора масса растворенного вещества не изменяется, а уменьшается лишь масса летучего растворителя - воды. Составим балансовое уравнение по массе растворенного вещества и определим объем исходного раствора, который необходимо взять для выпаривания: m (CaCl2/до выпаривания)=m (CaCl2/после выпаривания) или V1 ·r1 ·w1 = V·r·w, откуда Определим массу воды, которую необходимо выпарить:
m(H2O)=m(исх.р-р) – m(конечн.р-р)=V1·r1-V·r = 924,14 см3 ·1,015 г/см3 – 220 см3 ·1,066 г/см3 =703,48 г.
Ответ: нужно взять 924,14 см3 раствора с w (CaCl2) =2 % и 703,48 см3H2O. Пример 2. Какие объемы газообразного аммиака (н.у.) и его раствора с w (NH3) =3 % и плотностью r = 0,985 г/см3 необходимо взять для приготовления 100 см3 нашатырного спирта (раствор с w (NH3) =10 % и r = 0,957 г/см3). Решение. Запишем два уравнения материального баланса на основе двух составных частей смеси:
Составляем уравнения материального баланса 1) по массе смеси: 2) по массе аммиака Подставив данные задачи, получим систему двух уравнений:
Решая систему из двух уравнений, находим необходимые объемы 3 % раствора аммиака (V2) и объема аммиака (газа): V(NH3) =8,9 дм3; V2 = 90,3 см3 Ответ: для приготовления 100 см3 нашатырного спирта потребуется 90,3 см3 3% -ного раствора аммиака (r = 0,985 г/см3) и 8,9 дм3 (н.у) NH3 Пример 3. Какой объем раствора соляной кислоты с w (HCl) = 20 % и r = 1,098 г/см3 необходим для приготовления одного литра 2М раствора? Решение. Исходный раствор HCl является более концентрированным, чем 2 М раствор и приготовление последнего связано с разбавлением первого раствора водой. Поскольку при добавлении чистого растворителя содержание чистого вещества не меняется, то взятый для приготовления объем Vр-ра с w (HCl) =20 % должен содержать такую же массу HCl, что и конечный разбавленный раствор: m исх.р-р (HCl) =m конечн.р-р (HCl) или V·r·w (HCl) =c(HCl)·V·M(HCl) или V ·1,098 г/см3 · 0,20 = 2 моль/дм3 ·1 дм3 ·36,5 г/моль, тогда V = Ответ: объем раствора кислоты необходимый для приготовления 1 дм3 2 М раствора HCl, равен 332,4 см3. Методика приготовления 2 М раствора: в мерную колбу на 1 дм3 вносят 332,4 см3 исходного раствора с w (HCl) =20 % и затем разбавляют дистиллированной водой до метки, до общего объема в 1 дм3. Если при смешивании растворов некоторых веществ протекают химические реакции, то количества реагирующих веществ находят через заданные концентрации растворов. В этих случаях важно безукоризненно знать формулировку каждого способа выражения концентрации раствора, а также формулы связи между концентрациями, количеством растворенного вещества и его массой. Кроме того, следует обратить внимание на правильное определение качественного и количественного состава раствора после окончания химической реакции, а также правильное вычисление его массы: 1) количества n [ моль ]продуктов реакции определяет исходное вещество, взятое в недостатке, а исходное вещество, взятое в избытке, всегда присутствует в конечной смеси веществ; 2) масса конечной смеси равна сумме масс составляющих ее исходных растворов и чистых веществ, из которой необходимо вычесть массы всех газообразных и малорастворимых продуктов реакции, которые покидают раствор (образование осадка; выделение газа); 3) объем конечной смеси приближенно равен сумме объемов исходных растворов, а при растворении твердых и газообразных веществ конечный объем раствора считается равным объему растворителя. Для достаточно разбавленных растворов можно принять, что rр-р @ r(H2O) =1 г/см3. Пример 4. В 250 г раствора фосфорной кислоты с w (H3PO4) = 9,8 % растворили при нагревании 14,2 г оксида фосфора (V). Определить массовую долю растворенного вещества в конечном растворе. Решение. 1) При растворении P2O5 в растворе фосфорной кислоты образуется дополнительное ее количество в результате химической реакции: P2O5 + 3H2O (растворитель) ® 2H3PO4(р-р), поэтому масса кислоты в конечном растворе равна: m(H3PO4)=m исх.р-р (H3PO4) + m(H3PO4). Рассчитаем каждое слагаемое в отдельности: m исх.р-р (H3PO4) =mр-р ·w (H3PO4) =250 г · 0,098 = 24,5 г m(H3PO4/пореакции)=n(H3PO4) М(H3PO4)= тогда mобщ(H3PO4) =24,5 г + 19,5 г = 44,0 г 2) Масса конечного раствора кислоты равна: m(конечн.р-р)=m(исх.р-р) + m(P2O5) =250 + 14,2 = 264,2 г и w конечн.р-р (H3PO4))= Ответ: массовая доля ортофосфорной кислоты в конечном растворе составила 16,69 %. Лабораторная работа № 1. Требования, предъявляемые к химическим реакциям в объемном анализе. 1) взаимодействие между определяемым веществом и реагентом должно протекать в определенных стехиометрических отношениях; 2) отсутствие побочных взаимодействий в анализируемом растворе; отсутствие мешающих ионов, способных взаимодействовать с данным реагентом; 3) реакция определяемого иона с реагентом должна протекать с достаточно большой скоростью, в противном случае метод прямого титрования неприменим – используют метод непрямого титрования (обратного; титрования заместителя); 4) наличие и возможность использования подходящего индикатора для определения точки конца титрования. При проведении титрования к известному объему раствора (аликвотной части) определяемого вещества малыми порциями (по каплям) добавляют раствор реагента с точно известной молярной концентрацией эквивалента – стандартный раствор – до тех пор, пока его количество не станет эквивалентно количеству определяемого вещества, содержащегося в аликвотной части исследуемого раствора – до точки конца титрования. Момент, когда количество стандартного раствора реагента эквивалентно количеству определяемого вещества, содержащегося в аликвотной части титруемого раствора, называется точкой эквивалентности или теоретической точкой конца титрования. Для экспериментального установления ТКТ, точки эквивалентности используют индикаторы. Индикаторы – вспомогательные вещества, которые вводят в реакционную смесь. Они способны претерпевать видимые изменения в ТКТ (точке эквивалентности), в результате чего может изменяться или появляться окраска раствора, появляться помутнение, образование осадка, изменение цвета осадка. Точка конца титрования, фиксируемая при помощи индикатора, теоретически может не совпадать с точкой эквивалентности. Задача правильного выбора индикатора состоит в том, чтобы различие между точкой конца титрования и точкой эквивалентности было минимальным. Изменение окраски индикатора должно быть резким и происходить от одной избыточной капли прибавленного рабочего раствора реагента. Прибавление следующей капли рабочего раствора реагента не должно сказаться на окраске индикатора.
Метод нейтрализации. Методом нейтрализации путем прямого титрования можно определять содержание в анализируемых растворах сильных и слабых кислот, растворимых в воде оснований, кислых и гидролизующихся солей. В качестве реагентов (титрантов) используются стандартные растворы сильных кислот и оснований (щелочей). Стандартными называют водные растворы реагентов с точно известной молярной концентрацией эквивалента вещества в растворе. Точку конца титрования устанавливают в присутствии кислотно-основных индикаторов. – титрование сильных оснований или сильных кислот. В результате титрования в точке эквивалентности образуется соль сильного основания и сильной кислоты, которая не гидролизуется; рН раствора = 7. Наиболее подходящий кислотно-основный индикатор, показатель титрования (рТ) которого лежит в слабокислой или слабощелочной области, это растворы фенолфталеина или метилоранжа.– титрование слабых оснований. В точке эквивалентности образуется гидролизующаяся соль – соль слабого основания и сильной кислоты. В результате гидролиза соли рН раствора в точке конца титрования будет меньше 7, следовательно, индикатор должен менять свою окраску в кислой среде. Такими свойствами обладают метиловый красный (метилрот), метиловый оранжевый (метилоранж). – титрование слабых кислот. При титровании раствора слабой кислоты раствором сильного основания в точке конца титрования образуется соль, вследствие гидролиза которой раствор имеет щелочную реакцию. Для фиксирования точки эквивалентности используют индикатор, способный изменять окраску в слабощелочной среде. Такими свойствами обладают фенолфталеин, тимолфталеин, метилоранж.
Лабораторная работа №2 Титриметрическая реакция
в точке эквивалентности, согласно формуле (4.1), выполняется закон эквивалентов:
Диссоциация слабой кислоты Слабые кислоты диссоциируют обратимо; слабые многоосновные кислоты – обратимо и ступенчато. Пусть молярная концентрация приготовленного раствора слабой кислоты равна с 0, а ее степень диссоциации 0 < a << 1; к моменту установления равновесия продиссоциировало с дис. = a с 0 кислоты, тогда:
Молярные концентрации всех компонентов раствора в состоянии динамического равновесия называют равновесными концентрациями и записывают их в квадратных скобках. Связь между равновесными концентрациями осуществляется через константу диссоциации, величину которой при необходимости можно найти в справочнике: Кдис. =
где для слабых электролитов часто используют приближённую формулу, считая, что с 0 – [H+]» с 0, поскольку с 0 >> сдис. = [H+]. C другой стороны, в выражение для константы диссоциации, можно ввести степень диссоциации: Кдис . = Таким образом, a» Зависимость степени диссоциации слабого электролита от его природы (Кдис.) и концентрации в растворе называют законом разбавления Оствальда: при разбавлении раствора слабого электролита степень его диссоциации растет. Концентрацию ионов водорода в растворе слабой кислоты с учетом равновесия ее диссоциации рассчитывают по уравнению: [H+] = [X–] = a с 0 =
В случае диссоциации слабых многоосновных кислот используется аналогичная расчётная схема, в которой учитывается диссоциация только по первой ступени, а диссоциацией по следующим ступеням можно пренебречь, т.к. Кдис. по последующим ступеням достаточно низкие, что является основанием учета диссоциации по первой ступени. В этом случае для расчётов концентрации ионов водорода в растворах слабых многоосновных кислот используют справочныее значения их констант диссоциации по первой ступени. Константу диссоциации кислоты принято обозначать К а (от английского слова asid - кислота).
Диссоциация воды. Ионное произведение воды Кw. Аналогичные по форме соотношения можно получить при расчёте равновесия диссоциации слабого основания, например, гидроксида аммония NH4OH:
NH4OH Û NH4+ + OH- a» где с 0 – молярная концентрация аммиака в его растворе, а Кдис . – справочное значение константы диссоциации гидроксида аммония; константу диссоциации основания обозначают Кb (от английского слова base – основание). Диссоциация слабого электролита – обратимый процесс, в котором положение равновесия можно смещать влево (подавление диссоциации) за счёт добавления в раствор сильных электролитов, при диссоциации которых образуется ион, одноимённый с ионом слабого электролита. Смещение равновесия вправо достигается за счёт связывания продуктов диссоциации в менее диссоциирующие соединения. Например, диссоциацию уксусной кислоты можно подавить за счёт добавления в её раствор ацетата натрия или сильной кислоты, поставляющей в раствор Н+. Особый интерес представляет диссоциация воды – слабого амфотерного электролита: H2O Û H+ + OH-, где равновесные концентрации ионов связаны друг с другом через константу диссоциации: Кдис . = ее величина может быть вычислена при любой температуре на основании данных измерения электропроводности чистой воды. При 22 0С Кдис . равна 1,8·10-16; пренебрегая ничтожно малой степенью диссоциации воды, концентрацию молекул воды как в чистой воде, так и в разбавленных водных растворах можно считать величиной постоянной:
Тогда выражение для константы диссоциации можно переписать:
произведение [Н+]·[ОН-]=10-14 называют ионным произведением воды и обозначают Кw: [OH-]·[H+]= Кw =10-14 (5.11) Для чистой воды и для разбавленных водных растворов любых веществ ионное произведение воды Кw при данной температуре является величиной постоянной и равно 10-14. С повышением температуры Кw возрастает, с понижением – уменьшается. Так, например, при 100 0С ионное произведение воды Кw =10-12. Используя величину ионного произведения воды Кw и известную концентрацию одного из ионов воды, исходя из формулы (5.11), можно вычислить концентрацию ионов Н+ и ОН- в любом водном растворе:
В чистой воде из условия электронейтральности:
Растворы, в которых [Н+]=[ОН-] =10-7 моль/дм3, называются нейтральными. Если [H+] > [OH-] > 10-7 моль/дм3 (>10-6...10-1моль/дм3) растворы называются кислыми, если [H+] < [OH-] < 10-7моль/дм3 – щелочными растворами (<10-8...10-14 моль/дм3). На практике кислотность раствора в водных средах принято характеризовать не молярной концентрацией ионов водорода или гидроксила, а безразмерной величиной – водородным показателем рН. Водородный показатель рН – количественная характеристика кислотности среды – величина, равная отрицательному десятичному логарифму равновесной концентрации ионов водорода в растворе: рН = -lg[H+]. Аналогично гидроксильный показатель рОН: рОН = -lg[OH-]. В любом водном растворе [OH-]·[H+]=Кw=10-14 (при 220С). Логарифмируя это выражение и учитывая выражения для рН и рОН, получаем: рН + рОН = 14 (5.12) В нейтральной среде рН = рОН = 7,0; в кислой среде рН < 7,0; в щелочной – рН > 7,0. В разбавленных водных растворах различных веществ величина рН меняется от 0 до 14. ОБУЧАЮЩИЕ ЗАДАЧИ 1.Вычислить ионную силу в растворе 0,1 моль/дм3 сульфата натрия. Решение: Na2SO4→2Na+ + SO42- c [
2. Вычислить концентрацию ионов ОН-, рОН и рН для 0,1 моль/дм3 раствора аммиака (К b =1,76·10-5). Решение: NH3 + H2O Û NH4OH Û NH4+ + OH-
Ответ: [ОН-]=1,32·10-3; рОН=2,88; рН=11,12.
3. Константа диссоциации уксусной кислоты равна 1,75 10-5. Определите массу ацетата натрия, которую необходимо добавить к 300 см3 0,1 моль/дм3 раствора уксусной кислоты, чтобы понизить концентрацию ионов водорода в растворе в 100 раз. Найдём равновесную концентрацию ионов водорода в 0,1 моль/дм3 растворе CH3COOH:
При добавлении CH3COONa концентрация ионов H+ должна быть в 100 раз меньше (диссоциация частично подавлена), т.е. 1,32 ∙ 10-5 моль/дм3. Пусть необходимо внести в 1 дм3 исходного раствора кислоты х моль соли, что соответствует добавке x моль ацетат- и
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 160; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.127.59 (0.011 с.) |

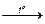 концентрирование раствора путем упаривания растворителя.
концентрирование раствора путем упаривания растворителя. из соображения, что n(CaCl2) = n(CaCl2·6H2O)
из соображения, что n(CaCl2) = n(CaCl2·6H2O)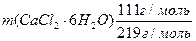 = 220 см3 ·1,066 г/см3 ·0,08 = 18,76 г
= 220 см3 ·1,066 г/см3 ·0,08 = 18,76 г

 и
и

 , где Vm = 22,4 дм3 /моль.
, где Vm = 22,4 дм3 /моль.

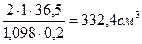 .
.
 или 16,69 %
или 16,69 %
 , (5.7)
, (5.7) ,
, (5.8)
(5.8) (5.9)
(5.9) и [OH-] = [NH4+] = a × с 0 =
и [OH-] = [NH4+] = a × с 0 =  ;
; .
.

 .
.
 ]: 0,1 0,2 0,1
]: 0,1 0,2 0,1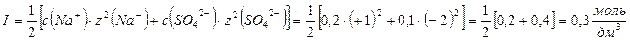 Ответ: ионная сила 0,1 моль/дм3 Na2SO4 равна 0,3 моль/дм3.
Ответ: ионная сила 0,1 моль/дм3 Na2SO4 равна 0,3 моль/дм3.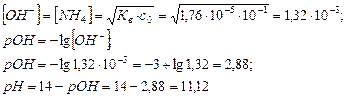
 .
.


