
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення рн буферних розчинівСодержание книги
Поиск на нашем сайте ПОТЕНЦІОМЕТРИЧНИМ МЕТОДОМ
Ціль роботи: Визначити рН буферних розчинів потенціометричним методом. Послідовність виконання роботи Використовуючи 0,1н. розчин оцтової кислоти й оцтово-кислого натрію приготувати п'ять буферних розчинів. Загальна кількість буферної суміші й кількості CH3COOH і CH3COONa задає викладач. Визначити величини рН буферних розчинів на рН-метрі. Розрахувати величини рН по вищенаведеному рівнянню (6.11, 6.10, 6.9) й порівняти з отриманими эксперементально значеннями. Дані занести в таблицю 6.1.
Таблиця 6.1 Склад і рН буферних розчинів
Контрольні питання 1. Що таке йонний добуток води? 2. Що таке рН розчину? Які значення має рН? 3. Як розрахувати рН розчину, якщо відома концентрація гідроксид-йонів? 4. За допомогою яких електродів визначають рН розчину? 5. Розповісти про будову скляного електроду. 6. Розповісти про будову хлорсрібного електроду. 7. Буферні розчини та їх властивості. 8. Що таке буферна ємність розчину? 9. Як розрахувати коефіцієнт активності? 10. Що таке йонна сила розчину?
Лабораторна робота №14
ВИЗНАЧЕННЯ СТУПЕНЯ Й КОНСТАНТИ ДИСОЦІАЦІЇ СЛАБКОГО ЕЛЕКТРОЛІТУ МЕТОДОМ ЕЛЕКТРИЧНОЇ ПРОВІДНОСТІ
Ціль роботи – установити залежності питомої й еквівалентної електричних провідностей від концентрації розчину (або розведення) і визначити ступені й константи дисоціації слабких електролітів. Теоретичні відомості Молекули електролітів у водних розчинах дисоціюють на йони, які і є носіями зарядів. Електрична провідність слабких електролітів, які дисоціюють у водних розчинах частково, визначається в основному ступенем дисоціації, що залежить від концентрації електроліту та температури. Ступінь дисоціації α можна визначити методом виміру електричної провідності. Розрізняють питому й еквівалентну електричні провідності. Питома електрична провідність χ - величина, зворотна питомому опору:
Електричний опір провідника R пов'язаний з питомим опором ρ рівнянням R ═ ρ де ℓ - довжина провідника; s - площа поперечного переріза. Таким чином, Відповідно до закону Ома де U – напруга; I – сила струму. Отже,
Питома електрична провідність χ дорівнює електричній провідності 1 см3 розчину, який міститься між плоскими паралельними електродами, що знаходяться на відстані 1 см один від одного провідники з одиничними розмірами (Ѕ = 1, ℓ = 1), її виражають в Ом-1м-1. Еквівалентна (молярна) електрична провідність λ – це провідність розчину такого об’єму, в якому міститься один моль електроліту, і розчин вміщений між плоскими паралельними електродами, що знаходяться на одиничній відстані один від одного, і розраховується за рівнянням
де С – еквівалентна концентрація, моль/л; V – розведення (об'єм розчину, який містить 1 моль розчиненої речовини, см3). Еквівалентна електрична провідність слабких електролітів збільшується з розведенням внаслідок зростання ступеня дисоціації електроліту. Відповідно до закону незалежного руху йонів у розведених розчинах (закон Кольрауша)
де λ+∞ і λ-∞ йонні електричні провідності при нескінченному розведенні або рухливості йонів. Рухливості йонів пропорційні абсолютним швидкостям руху йонів:
λ+ ═ Fυ+, λ- ═ Fυ-, (6.21)
де υ+ і υ- - абсолютні швидкості руху, см2·с-1·В-1 (F = 96500 Кл – стала Фарадея). Абсолютною швидкістю руху йонів називається швидкість, з якої йони рухаються в електричному полі з градієнтом потенціалу 1В/см. Рухливості йонів залежать від температури, природи йона та природи розчинника. Обчислимо значення λ за рівнянням (6.19) і λ∞ для слабкого електроліту за рівнянням (6.20), використовуючи значення йонних электрорухливостей (додаток табл. 8, 9) і перераховуємо для відповідної температури. Розрахуємо його ступінь дисоціації
За законом розведення Оствальда визначимо константу дисоціації слабкого електроліту К, що залежить від температури, природи розчиненої речовини й природи розчинника. Для бінарного електроліту (КА ↔К++ А-)
де С – концентрація електроліту.
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 408; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |

 ,мл
,мл
 ,мл
,мл

 (6.14)
(6.14)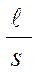 , (6.15)
, (6.15) (6.16)
(6.16) , (6.17)
, (6.17) (6.18)
(6.18) , (6.19)
, (6.19) , (6.20)
, (6.20) (6.22)
(6.22) , (6.23)
, (6.23)


