
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Будова атома і молекули, електричні та оптичні властивостіСодержание книги
Поиск на нашем сайте
Рефрактометрія
2.I. Поляризація молекул Усі молекули можуть бути розділені на два типи: неполярні й полярні (з несиметричним і симетричним розподілом зарядів). Полярну молекулу називають також дипольною, або диполем. У двохатомному диполі на одному з атомів утворюється надлишок негативних, на іншому – такий же надлишок позитивних зарядів. У багатоатомних молекул існують деякі області з надлишком позитивних і негативних зарядів. Однак і тут можна уявити собі два центри зарядів. Дипольним моментом μ називають добуток заряду на відстань між зарядами. Дипольний момент має властивості векторів. При поміщенні неполярної молекули в електричне поле під дією електричного поля сусідньої полярної молекули або йона атоми й легкорухливі електрони перетерплюють деякі зміни, відбувається зсув зарядів відносно один одного, що створює індукований (наведений) дипольний момент. Внаслідок існування власного (постійного) дипольного моменту полярна молекула прагне орієнтуватися уздовж напрямку поля, крім того, в ній, як і в неполярній виникає наведений момент. Зсув електронів, атомів, орієнтація молекули в електричнім полі називається поляризацією. Поляризація молекули Р складається з електронної Рел, атомної Рат і орієнтаційної Рор. Р = Рел+ Рат + Рор (2.1) Електронна й атомна поляризація не залежить від температури, орієнтаційна – обернено пропорційна абсолютній температурі, тому що хаотичний тепловий рух молекул порушує орієнтацію
де ε – відносна діелектрична проникність, М – молярна маса (г), ρ – густина речовини (г/см3), М/ρ – молярний об'єм (см3/моль). При зміні напрямку зовнішнього електричного поля відбувається переорієнтація полярних молекул і зміна напрямку вектора наведеного диполя. При збільшенні частоти електричного поля спочатку відпадає орієнтаційна (при ν ~1010 Гц, λ ~ 1см), потім атомна (при ν ~ 1013 Гц, λ ~ 10-4 см) складові поляризації, тому що молекули й атоми, що мають порівняно більшу масу, не встигають за зміною напрямку електричного поля, і залишається тільки електронна поляризація. 2.2 Молярна рефракція. При частотах видимого світла порядку 1015 Гц (λ= 450-750нм) проявляється тільки електронна поляризація Рел, яку називають молярною рефракцією R, см3/моль
де n – показник заломлення для променів видимого світла. Згідно зі співвідношенням Максвелла, при нескінченно великій довжині хвилі ε = n2∞, але для наближених визначень рефракції досить користуватися показником заломлення променів видимого світла. За стандарт обрана жовта лінія натрію (позначають символом D, довжина хвилі λD=589,3 нм). У довідкових таблицях усі дані, як правило, наведені для цієї довжини хвилі. Експерементально встановлено, що рефракція молекули наближено є сумою рефракцій окремих йонів, атомів або зв'язків, що входять до неї. Цю властивість рефракції (адитивність) можна пояснити тим, що зсув електронів у молекулі мало залежить від того, у які молекули входять такі групи. Крім того, зсув електронів незначно змінюється з температурою й агрегатним станом речовини. У речовин з однаковою емпіричною формулою, але різною будовою, рефракції різні. Наявність у сполуках кратних зв'язків і напружених циклів, що утворюються за рахунок π-зв'язків з легкорухливими електронами, збільшує їхню молярну рефракцію.
R = ΣmRат + ΣmRкр.зв. + ΣmRциклів (2.4)
де m – число атомів, кратних зв'язків, циклів. Адитивність рефракції дозволяє встановити структуру молекули шляхом добору такої структурної формули, для якої вирахована молекулярна рефракція за наведеним рівнянням дорівнює експерементально отриманому значенню.
Лабораторна робота №4.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 307; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.85.96 (0.007 с.) |

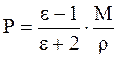 , (2.2)
, (2.2)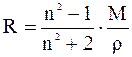 (2.3)
(2.3)


