
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Побудова та аналіз діаграм плавкостіСодержание книги
Поиск на нашем сайте
І3 ПРОСТОЮ ЕВТЕКТИКОЮ
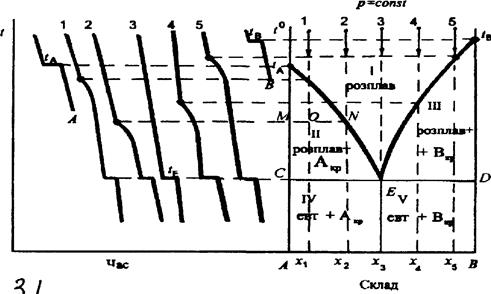
Діаграми плавкості цього типу найбільш поширені та характерні для бінарних систем неізоморфних речовин, що не утворюють хімічних сполук, наприклад, свинець—сурма, калію хлорид— літію хлорид, а-нафтол—нафталін, фенол—метиламін, камфора—бензойна кислота, аспірин—фенацетин та ін. Фігуративні точки tA та tB на діаграмі плавкості (рис. 4.1) відповідають температурам плавлення (кристалізації) чистих компонентів А та В. У відповідності із законом Рауля, при додаванні компонента В до А температура кристалізації А знижується. Аналогічно при додаванні А до В знижується температура кристалізації В. Лінії tAE та tBE називають лініями ліквідусу. На відміну від чистих компонентів бінарні суміші кристалізуються (плавляться) не при сталій температурі, а у певному інтервалі температур, який визначається складом системи. Найнижча температура, при якій закінчується кристалізація розплаву будь-якого складу (або починається плавлення суміші), називається евтектичною температурою tE. Лінія CD, яка відповідає евтектичній температурі, нижче якої не може існувати рідка фаза, називається лінією солідусу. Точку перетину ліній ліквідусу tAE та tBE з лінією солідусу CD називають евтектичною (точка E), а розплав, склад якого відповідає точці х3 — евтектичним розплавом (він насичений, відносно обох компонентів). Суміш дрібних кристалів компонентів А та В, яка утворюється при охолодженні цього розплаву, називається евтектичною, або евтектикою.
Рис. 4.1. Побудова діаграми плавкості з простою евтектикою за кривими охолодження
Складові частини евтектики добре видно під мікроскопом. Їх можна відділити одну від одної механічним шляхом або за допомогою розчинників. Як зазначено вище, для систем, що складаються із розплавлених та твердих речовин, паровою фазою та параметром тиску можна знехтувати і тоді правило фаз Гіббса записується так: С = К — Ф + 1. У відповідності з цим рівнянням для точок на кривих плавлення число ступенів свободи дорівнює одиниці, тобто довільно та у невеликих межах можна змінювати лише одну змінну, щоб не порушити рівноваги у системі. Друга змінна при цьому змінюється у функціональній залежності від першої. В точці перетину кривих плавлення, тобто в евтектичній точці Е, в рівновазі перебувають три фази — дві тверді та розплав, а тому С = 0. В полі 1 С = 2, довільно та у невеликих межах можна змінювати обидва параметри, не змінюючи числа та вигляду фаз, які перебувають у рівновазі, тому що зміна складу розплаву не розглядається як зміна вигляду цієї фази. Поле II відповідає умовам (t, с), за яких співіснують твердий компонент А та розплав із А і В, а поле III — розплав із А і В та твердий компонент В. Діаграма стану дозволяє у будь-якій точці О (рис. 4.1) визначити не лише число рівноважних фаз і їх склад, але й маси рівноважних фаз за допомогою правила важеля. Для цього проводять через точку О горизонтальну лінію MN, яка називається конодою, або нодою. За точками М і N визначають склад рівноважних фаз. Фігуративній точці О в полі II відповідає система, що містить х1% компоненту В. При температурі t1 вона складається з двох рівноважних фаз: кристалів компонента А (точка М) і розплаву (точка N, х2% компоненту В). Загальний матеріальний баланс можна представити у вигляді рівняння m0 = m1 + m2, де m0 — маса всієї системи; т1 і т2 — маса кристалів і розплаву відповідно. Матеріальний баланс компоненту В описується рівнянням:
Підставимо значення т0 і одержимо:
Таким чином, кількості твердої і рідкої фаз обернено пропорційні довжинам відрізків ОМ i ON. Розглянемо один із способів побудови діаграм плавкості. Речовини А та В, з яких утворена дана система, а також ряд сумішей цих речовин різного складу розплавляють. Потім кожний з одержаних розплавів охолоджують та вимірюють його температуру за допомогою точного термометра або термопари через певні та невеликі проміжки часу. Одержані дані представляють у вигляді графіка в координатах температура — час. Запис кривих охолодження може бути здійснено автоматично. Якщо при охолодженні (нагріванні) в системі відбуваються фазові перетворення (наприклад, випадіння твердої фази з рідини, перехід однієї поліморфної модифікації в іншу), то теплота, яка виділяється (поглинається) при перетворенні, змінює швидкість спадання (зростання) температури системи, що приводить до зміни кутового коефіцієнта кривої температура — час. Тому у проміжки часу, які відповідають температурам фазових перетворень, на кривих охолодження з'являються злами або горизонтальні ділянки. Розглянемо процес охолодження сумішей різного складу. Криві охолодження А та В (рис. 4.1) належать відповідним чистим компонентам, а криві 1, 2, 3, 4, 5 — сумішам складу x1, x2, x3, x4, x5, в яких вміст компонента В поступово збільшується. Криві охолодження А та В починаються похилими лініями, які відповідають охолодженню розплавів чистих компонентів до температури їх кристалізації, горизонтальні ділянки відображають процеси кристалізації компонентів А та В, тому що теплота кристалізації, яка виділяється, практично компенсує втрату тепла у навколишнє середовище. Потім ідуть похилі лінії, які характеризують швидкість охолодження затверділих чистих речовин. Крива 3 відображає процес охолодження евтектичної суміші (евтектичний склад х3). Горизонтальна ділянка на цій кривій вказує на значне виділення тепла при сталій температурі, що можна пояснити тільки повним затвердінням розплаву та перетворенням його у тверду евтектику такого ж складу. Злами на кривих 1 та 2 відповідають температурам кристалізації компоненту А з розплавлених сумішей складу x1 та х2, в яких вміст А більший, ніж в евтектиці. Тут не спостерігається повної зупинки температури, бо по мірі кристалізації компоненту А розплав збагачується компонентом В, що призводить до подальшого зниження температури кристалізації А та потребує для його виділення ще більшого охолодження розплаву. Другі (горизонтальні) зупинки температури на кривих 1, 2 пояснюються тим, що у результаті кристалізації компоненту А склад розплаву стає евтектичним і він повністю кристалізується. Аналогічно пояснюється хід кривих 4, 5. Але у розплавах складу х4 і x5 надлишком (у порівнянні з його вмістом у евтектиці) є компонент В і тому злами на кривих відповідають початку його кристалізації із відповідних розплавів. Горизонтальні ділянки на цих кривих, як і на кривих 1, 2, 3, відображають процес затвердіння евтектики. За допомогою отриманих кривих охолодження будують діаграму плавкості з простою евтектикою, як показано на рис. 4.1. Температура на обох осях ординат повинна бути відкладена у однаковому масштабі. Обладнання для визначення температур кристалізації Термічний аналіз системи нафталін - бензойна кислота виконується на установці, схема якої зображена на рис.3.2.
Рис. 4.2. Схема установки для визначення температур кристалізації: 1 – хромелевий дріт термопари; 2 – алюмелевий дріт термопари; 3 – гарячий спай термопари; 4 – ізолююча фарфорова трубка; 5 – скляний чохол для термопари; 6 – фарфоровий тигель з досліджуваним розплавом; 7 – вогнетривкий (шамотний) тигель, наповнений піском; 8 – холодний спай термопари; 9 –посудина Дьюара; 10 – електронний автоматичний потенціометр. Термопара. Температуру вимірюють за допомогою термопари, що складається з хромелевого і алюмелевого дротів, кінці яких з однієї сторони зварюють (гарячий спай) (рис.4.2). Типи термопар наведено в табл. 4.1. Таблиця 4.1 Типи термопар
Дроти ізолюють один від одного фарфоровою чи скляною трубкою. Термопару вміщують у скляний чохол у вигляді пробірки. Спай при цьому не повинен торкатися дна і бічних стінок чохла. Вільні кінці дротів (холодний кінець термопари) повинні знаходитися при постійній температурі, для цього їх поміщають у посудину Дьюара, або в лід, що тане. Термо ЕРС, що виникає між гарячим і холодним спаями, для термопар ТХ і ТХК у першому наближенні пропорційна різниці температур між ними і вимірюються електронним автоматичним потенціометром (ЕПП) і записується на стрічковій діаграмі друкуючою кареткою. Шкала приладу довжиною 275 мм градуйована в абсолютних мілівольтах і відповідає 11,8 мВ. Показання приладу розраховують за допомогою покажчика. Термопара повинна бути проградуйована в умовах, близьких до умов досліду по точках плавлення (чи кипіння) чистих речовин. У цьому випадку потрібно скористатися кривими охолодження нафталіну і бензойної кислоти, температури плавлення яких відомі: Тпл.нафталіну = 80,1°С; Тпл.бензойної кислоти= 122,5°С. Як третю точку беруть температуру киплячої води.
Рис. 4.3. Графік градуюровки термопари
Для побудови графіка градуюровки термопари на вісь абсцис відкладають дійсні температури, а на вісь ординат - показання потенціометра при їхній кристалізації (кипінні) у мілівольтах. Отримані точки з'єднують прямою, що служить для приведення показань потенціометра до дійсних значень температури (рис 4.3).
Лабораторна робота № 6
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 654; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.210.196 (0.006 с.) |



 або
або 





