
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теплоти розчинення і розведення.Содержание книги
Поиск на нашем сайте
Інтегральною теплотою розчинення DНт(розч) називають кількість теплоти, що виділяється чи поглинається при розчиненні 1моля речовини у визначеному великому об'ємі розчинника зутворенням розчину концентрації Ст. Теплоти розчинення порівняно невеликі. Для твердих речовин з атомними чи молекулярними решітками вони близькі до теплоти плавлення. Інтегральна теплота розчинення електролітів є алгебраїчною сумою двох величин: 1) поглинання теплоти при руйнуванні кристалічних решіток і віддалення іонів на відстані, відповідно до об'єму розчину ( 2) виділення теплоти при гідратації чи сольватації кожного йона молекулами розчинника ( У нескінченно розведеному розчині:
Обидві величини мають порядок сотень кДж/моль, але їх різниця невелика, не більш десятків кДж/моль. При великих концентраціях Інтегральна теплота розведення
Теплота нейтралізації. Нейтралізація 1 екв будь-якої сильної кислоти сильною основою в досить розведеному розчині супроводжується майже однаковим екзотермічним тепловим ефектом, що відповідає тому самому процесу — утворенню 1 моля рідкої води з гідратованих йонів Н aq + (Н3О+) і OH aq - по рівнянню
Н aq + + OH aq - ® Н2О(р) DН= - 55,9 кДж/моль (-13,36 ккал/моль).
При нейтралізації слабкої основи сильною кислотою чи навпаки протікають одночасно два процеси: а) дисоціація слабкого електроліту з відповідним тепловим ефектом б) процес нейтралізації. Тому
Теплота гідратоутворення DНгідр. — теплота, яку система виділяє, приєднуючи до 1 моля твердої безводної солі відповідну кількість кристалізаційної води. Безпосередньо визначити DHгідр. важко. Її визначають за законом Гесса з інтегральних теплот розчинення безводної солі і кристалогідрата в таких кількостях води, щоб отриманий розчин в обох випадках мав однакову концентрацію і був би досить розведеним.
Наприклад, теплоту гідратоутворення СаСl2×6Н2О можна одержати у такий спосіб:
Відповідно до закону Гесса:
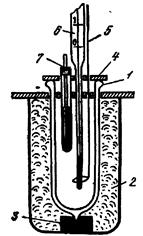
Визначивши експериментально теплоту розчинення безводної солі DH2 і теплоту розчинення кристалогідрату DH1 одержимо теплоту гідратоутворення DНх. Калориметр. Тепловий ефект реакції вимірюють у спеціальних приладах — калориметрах, спостерігаючи за зміною температури DТ при протіканні реакції. Для роботи користуються калориметром, що дозволяє робити визначення теплових ефектів з відносною похибкою 2—5% при зміні температури не менш 0,5°С. Калориметр складається з калориметричної посудини й ізолюючої системи. Схему найпростішого калориметра наведено на рис.1.1. Калориметр являє собою металеву склянку чи посудину Дьюара. Ізолюючою системою служить повітряна оболонка, що утворюється іншою посудиною і кришкою з пластмаси. Калориметрична посудина встановлюється в іншу посудину на азбестових чи пластмасових підставках. У кришці є отвори для термометра, мішалки і введення випробуваної речовини. Для зменшення втрат тепла в навколишнє середовище зміна температури при взаємодії речовин у калориметричній посудині не повинна перевищувати 2—3°С і реакція повинна протікати швидко. Теплові ефекти розраховують по зміні температури DТ при реакції в калориметрі і визначенню теплової сталої калориметра Сk. Величина Ck відповідає тій кількості теплоти, що необхідна для нагрівання калориметра на 1°С.
Рис. 1.1. Схема калориметру: 1 – металевий стакан або посудина Дьюара; 2 -повітряна оболонка; 3 - підставка; 4 - кришка; 5 - мішалка; 6-термометр Бекмана; 7 - ампула з досліджуваною речовиною. Величина Ck являє собою суму добутків теплоємностей тих частин приладу і розчину, що беруть участь у теплообміні, на їхню масу:
де mі — маси окремих частин приладу і рідини; сi — питомі теплоємності окремих частин приладу і рідини. Величину Ck можна обчислити приблизно як суму теплоємкостей склянки (посудини Дьюара), мішалки, води чи розчину. Для цього визначають масу металевих частин приладу з точністю до 0,01г, обчислюють їхню теплоємність. Теплоємність зануреної нижньої частини термометра Бекмана n визначають по витісненню води в мірному циліндрі. Теплоємність, віднесена до 1 мл ртуті і скла, однакова і дорівнює 1,92 Дж/мл. Тому теплоємність зануреної частини термометра дорівнює n = 1,92.
Точніше визначають Ck безпосереднім вимірюванням теплоємності, нагріваючи калориметр і вимірюючи зміну температури. Нагрівають електричним струмом, чи теплом одержуваним за рахунок хімічної реакції, наприклад, по відомій теплоті розчинення солі. Щоб нагріти систему на DТ, необхідно надати їй кількість теплоти DН:
де DН – відома теплота розчинення солі, кДж/моль; М — молекулярна маса солі, г/моль; g — наважка солі, г. Відповідно:
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 585; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.61.184 (0.01 с.) |

 );
); ).
).
 є функцією концентрації розчину. Для сильно розведених розчинів вона наближається до граничної величини
є функцією концентрації розчину. Для сильно розведених розчинів вона наближається до граничної величини  у нескінченно розведеному розчині.
у нескінченно розведеному розчині. являє собою теплоту розведення розчину, що містить 1 моль речовини при концентрації Ст, до нескінченного розведення. Співвідношення між
являє собою теплоту розведення розчину, що містить 1 моль речовини при концентрації Ст, до нескінченного розведення. Співвідношення між  і
і  - виражається рівнянням:
- виражається рівнянням:
 ;
; у цих випадках більше чи менше
у цих випадках більше чи менше 





 чи
чи 


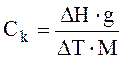 , кДж/г·град
, кДж/г·град



