
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотності-основності розчинівСодержание книги
Поиск на нашем сайте
Водневим показником рН називають десятковий логарифм концентрації йонів Гідрогену зі знаком мінус: pН= –lg [H+] (6.2) або
де [H+] – молярна концентрація йонів Гідрогену в розчині. Аналогічно концентрацію гідроксид-йонів виражають через показник рОН, який є десятковим логарифмом концентрації гідроксид йонів, взятий зі знаком мінус: рОН = –lg [ОН–]. (6.4) На основі йонного добутку води обчислюють концентрацію [H+]- та [ОH–]-йонів за формулами: рН + рОН = 14; (6.5)
рН = 14 – рОН; (6.6)
рОН = 14 – рН. (6.7) У кислих розчинах: [H+] > [ОН–] і pН < 7. У лужних розчинах: [H+] < [ОН–] і pН > 7. У чистій воді (нейтральне середовище): [H+] = [OH–] = 10–7 і pН = 7. Вся шкала кислотності-основності знаходиться в межах від 10–14 до нуля, моль йонів/л:
нейтральне середовище [H+] = [OH–] = 10–7
Значення рН характеризується активністю Н+, тобто йонів тільки одного виду. Але за допомогою досвіду можна знайти тільки середню йонну активність (для I-I - валентного електроліту У багатьох випадках необхідно мати розчини з певним значенням водневого показника (у якості останніх можуть бути використані буферні розчини). Буферні розчини. Буферними, називаються розчини, здатні зберігати досить постійним значення рН при розведенні або впливі інших розчинів. Звичайно буферний розчин складається із слабкої кислоти (або слабкої основи) і солі цієї кислоти (або основи), яка є сильним електролітом. Наприклад, суміш оцтової кислоти з ацетатом натрію, хлориду амонію з гідроокисом амонію. Відповідно до рівняння дисоціації оцтової кислоти СН3СООН константа дисоціації її дорівнює:
Введення в розчин кислоти добре дисоційованої солі цієї кислоти сильно зміщує рівновагу дисоціації вліво. У результаті активність недисоційованої кислоти стає практично рівною концентрації розчиненої кислоти, а активність аніона - рівною концентрації аніона доданої солі:
Значення коефіцієнта активності можна з деяким наближенням обчислити з рівняння
де z + і z- - заряд відповідно катіона й аніона; I – іонна сила розчину I = ½∑Ci· Підбір концентрацій кислоти й солі дозволяє приготувати розчин із заданим значенням рН. Буферні розчини володіють такою важливою властивістю, що розведення їх майже не змінює концентрації водневих йонів, тому що при розведенні відношення
Відбувається лише незначна зміна Додавання сильних кислот і лугів до буферних розчинів менше підвищує кислотність або лужність, ніж додавання їх у такому ж співвідношенні до води. Це явище пов'язане з так званою буферною ємністю. Останню, характеризують кількістю молів сильної кислоти або основи, яку необхідно додати до одного літру буферного розчину, що змінює рН на одиницю. Розведення буферних розчинів зменшує буферну ємність. При заданій концентрації найбільшою ємністю володіє розчин, у якому відношення кількість кислоти й солі дорівнює одиниці. Потенціометрія Потенціометрія – це методи,які дозволяють визначити різні фізико-хімічні величини і проводити кількісний аналіз на основі вимірювань ЕРС різних електрохімічних елементів. Потенціометричний вимір рН виконують за допомогою гальванічного елементу, один з електродів якого (індикаторний) оборотний щодо йонів водню, другий має постійний потенціал, що не залежить від властивостей досліджуваного розчину (електрод порівняння).
Рис.6.1 Схема електродної системи p-метра: Порожня кулька з електродного скла; 2 - розчин, що заповнює внутрішню порожнину електрода; 3 - внутрішній контактний електрод; 4 - допоміжний електрод; 5 - електролітичний контакт; 6 - пориста перегородка; 7 - pНметр; 8 - скляний електрод. Для виміру величини рН використовують електродну систему зі скляним електродом, електрорушійна сила якої залежить від активності йонів водню в розчині. Скляний електрод 8 являє собою трубку з напаяною на корпус порожньою кулькою 1 з літієвого електродного скла. При зануренні електрода в розчин, між поверхнею кульки електрода й розчином, відбувається обмін йонами, в результаті якого йони літію в поверхневих шарах скла заміщаються йонами водню, і скляний електрод здобуває властивості водневого електрода. Між поверхнею скла й контрольованим розчином виникає різниця потенціалів, обумовлена активністю йонів водню в розчині:
Для створення електричного кола при вимірі застосовуються контактні електроди: внутрішній контактний електрод 3 – хлорсрібний, здійснюючий електричний контакт із розчином HCl, що заповнює внутрішню частину скляного електрода, і зовнішній контактний електрод 4 (так званий електрод порівняння) – хлорсрібний електрод, здійснюючий електричний контакт із контрольним розчином. Для захисту від впливу високих температур (при вимірі рН гарячих розчинів) електрод порівняння поміщають поза контрольним розчином і з'єднують із ним за допомогою електричного ключа 5 – трубки, наповненої насиченим розчином KCl, що закінчується пористою перегородкою 6. Розчин KCl безупинно просочується через пористу перегородку, запобігаючи проникненню з контрольного розчину в систему електрода сторонніх йонів, які могли б змінити потенціал електроду. Електрорушійна сила електродної системи дорівнює алгебраїчній сумі контактних потенціалів φк і φвсп, потенціалу, що виникає на внутрішній поверхні скляного електроду φвн і обумовленого величиною рН внутрішнього розчину і потенціалу, що виникає на зовнішній поверхні скляного електроду φх. Величини φк і φвсп, φвн не залежать від вмісту контрольного розчину й міняються тільки при зміні температури.
де φ0 = φк + φвсп+ φвн. Електрорушійна сила електродної системи лінійно залежить від величини рН розчину. Замірюючи ЕРС електродної системи електронним мілівольтметром 7, шкала якого градуйована в одиницях рН, визначають величину рН контрольного розчину. Лабораторна робота №13
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 372; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.85.233 (0.006 с.) |

 , (6.3)
, (6.3)

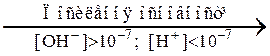
 ). Через це поняття активності йонів водню умовне, і шкалу значень рН приводять у відповідність із такими величинами, наприклад, константами дисоціації, значення яких можуть бути визначені точно. Вимірювання рН потенціометричним методом, дають погоджені з умовною шкалою дані.
). Через це поняття активності йонів водню умовне, і шкалу значень рН приводять у відповідність із такими величинами, наприклад, константами дисоціації, значення яких можуть бути визначені точно. Вимірювання рН потенціометричним методом, дають погоджені з умовною шкалою дані. СН3СОО¯+Н+
СН3СОО¯+Н+ , звідси
, звідси  .
.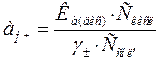 (6.8)
(6.8) (6.9)
(6.9) (6.10)
(6.10) (6.11)
(6.11) .
. через зміну коефіцієнта активності солі.
через зміну коефіцієнта активності солі.
 (6.12)
(6.12) , (6.13)
, (6.13)


