
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення істинної зміни температури в калориметрі при термохімічному процесі.Содержание книги
Поиск на нашем сайте
Для вимірювання температури користуються термометром Бекмана. При роботі з калориметром спостерігаються часткові втрати тепла в навколишнє середовище, що викривляє вимірювану різницю температур початку і кінця процесу. Для визначення істинної зміни температури використовують графічний метод. Весь калориметричний процес поділяють на три періоди: 1. попередній період 5 хв; 2. головний період, що відповідає протіканню термохімічного досліду (розчиненню солі чи реакції нейтралізації); 3. заключний період — 5 хв. Перемішуючи воду в калориметрі, спостерігають кожні 0,5 хв. за температурою, що змінюється в результаті обміну теплом з навколишнім середовищем. Коли встановлюється рівномірний хід температури, тобто коли зміни температури кожні 0,5 хв. стануть однаковими, починають записувати температуру через кожні 0,5 хв. із точністю до 0,005°С (попередній період). Виконують 10 відліків. На одинадцятому відліку починають розчинення солі чи іншу реакцію для вимірювання теплового ефекту, не виключаючи секундоміра і не перериваючи запису температури. Розмішують розчин і продовжують запис температури (головний період). Якщо температура змінюється дуже швидко, відлік можна робити з точністю до 0,1°С. По закінченні головногоперіоду, коли хід температури знову стане рівномірним (заключний період), роблять ще 10 відліків і дослід закінчують. Якщо відлік чергового показання термометра під час досліду не був зроблений, то слід підкреслити пропущений відлік і записати наступний на своє місце, під своїм порядковим номером. Інакше це скоротить плавний період і вплине на величини виправлення.
Рис.1.2. Графічний метод визначення істинної зміни температури в калориметрі при термохімічному процесі. За отриманими даними будують графік (рис.1.2) на міліметровому папері, відкладаючи по осі абсцис час t, а на осі ординат — температуру Т. На графіку 10см відповідає 1°С (при DТ>10), а 5хв. — 5см. Після нанесення на графік усіх досліджених даних при екзотермічному процесі вийде крива типу АВДЕ, де АВ — попередній період, ВД - головний, а ДЕ — заключний. Прямі АВ і ДЕ екстраполюють і час періоду ВД поділяють навпіл (точка С). З точки С опускають перпендикуляр до перетину з обома продовженими прямими. Відрізок між точками К і F, виражений у градусах, покаже дійсну зміну температури DT, викликану процесом, з урахуванням виправлення на теплообмін.
Лабораторна робота №1 ВИЗНАЧЕННЯ ТЕПЛОВОЇ СТАЛОЇ КАЛОРИМЕТРА
Завдання. 1. Визначити зміну температури в калориметрі в результаті розчинення певної наважки KCl. 2. Обчислити моляльну концентрацію розчину і за табличними даними визначити кількість теплоти, що виділилася. 3. Обчислити теплову сталу калориметра.
Виконання роботи. Ретельно розтерти в фарфоровій ступці 6 г калій хлориду. Зважити з точністю до 0,001г порожню пробірку з пробкою, висипати в неї наважку солі і знову зважити. По різниці обчислити наважку. Зважити в калориметричну склянку чи в посудину Дьюара 300 г дистильованої води (з точністю до 0,1 г). Зібрати калориметр, закрити його кришкою, вставити в неї пробірку так, щоб низ пробірки був покритий водою. В другий отвір опустити термометр Бекмана. Перед початком роботи перевірити настройку термометра, опустивши його в розчин у калориметрі. Кінець стовпчика ртуті повинен встановитися біля середини шкали. Записати показання термометра в попередньому періоді. Після десятого відліку висипати сіль у воду і зважити пробірку. При розчиненні солі температура падає, потім починає рівномірно зростати. Початок підвищення температури відповідає кінцю головного періоду. Визначити графічно DT і обчислити теплову сталу Ck за рівнянням (1.18). Інтегральна теплота розчинення калій хлориду (DН, кДж/моль) визначається за табличними даними (додаток табл.7), для цього заздалегідь розрахувати концентрацію розчину
g1 – маса речовини (солі), г; g2 – маса розчинника, г; М – молекулярна маса речовини, г/моль. Результати вимірювань записати в табл. 1.1:
Таблиця 1.1
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 280; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.23.110 (0.006 с.) |


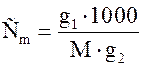 (1.19)
(1.19)


