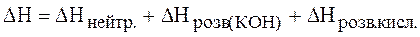Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення теплоти нейтралізації сильної кислоти сильною основою у водіСодержание книги
Поиск на нашем сайте
Завдання: 1. Визначити теплову сталу калориметра. 2. Визначити теплоту розведення концентрованої сильної кислоти. 3. Визначити теплоту нейтралізації концентрованої сильної кислоти сильною основою. Виконання роботи. Теплову сталу калориметра обчислити за рівнянням (1.18), як показано в роботі №1. При змішуванні розчинів кислоти і основи поряд з нейтралізацією відбувається розведення кислоти і основи. Вимірюваний у калориметрі тепловий ефект DH є сумарною величиною:
Для нейтралізації брати невеликий надлишок основи, щоб цілком нейтралізувати кислоту. Якщо вихідна концентрація кислоти в багато разів більше концентрації основи, то величиною DНрозв(кон) можна знехтувати і прийняти, що DH=DHнейтр. + DНрозв.кисл. Визначити концентрацію приблизно приготовленого 4 н. розчину кислоти, потім виміряти в калориметрі теплоту розведення. Для цього в ампулу, заздалегідь зважену, ввести близько 75 мл цієї кислоти. Наважку кислоти g1 визначити по різниці мас ампули з кислотою і без неї. Розрахувати об'єм V кислоти з g1 і її густини r. У калориметричну посудину налити 350 мл дистильованої води, зібрати калориметр (рис.1.1), вміщуючи ампулу у відповідний отвір кришки. Спостерігати за зміною температури так само, як і при визначенні теплоти розчинення солі (робота 1). У момент 11-го відліку ампулу розбити вістрям скляної палички і визначити, при безперервному перемішуванні, зміну температури DТ. Теплоту розведення 1екв. кислоти розрахувати по формулі:
де Cк — розрахована теплова стала калориметра, кДж/г·град; V — об'єм кислоти, мл; СЕ— нормальність кислоти, моль-екв/л.
Потім калориметр розібрати і промити всі його частини дистильованою водою. У калориметричну посудину налити 350 мл 0,2 н. розчину основи. Взяти приблизно таку ж наважку кислоти, як при визначенні теплоти розведення кислоти, і провести дослід аналогічно попередньому. Розрахувати сумарний тепловий ефект за рівнянням (1.14). По різниці DH і DHрозв. обчислити DНнейтр. Значення DHрозв. слід відняти від сумарної теплоти нейтралізації, тому що реакція розведення ендотермічна. Запис результатів вимірювань див. у роботі 1.
Контрольні питання 1. Чому теплові ефекти реакцій, що протікають при постійних об'ємі та тиску, є функціями стану системи? 2. Що таке теплоти утворення, нейтралізації, розчинення, розведення? 3. Як обчислити тепловий ефект реакції по теплотам утворення і теплотам згоряння речовин? 4. Описати методи визначення теплової сталої калориметра і істинної зміни температури в ньому. Чому треба записувати хід температури, а не тільки початкове і кінцеве значення її? 5. Як використовувати закон Гесса для визначення DН реакції, що неможливо при експериментальному визначенні? Привести приклади. 6. Чому DH нейтралізації залежить від природи реагуючих речовин? 7. Визначте тепловий ефект хімічної реакції при стандартних умовах 2NaОН(р) + CO2(г.) = Na2CO3(р) + H2O(р) 8. Визначте при температурі 298 K і тиску 1,013 · 105 Па тепловий ефект реакціїAl2O3(корунд) + 3SO3 D Al2(SO4)3(кр) + ΔH0x. 9. Визначте роботу ізобарного оборотного розширення 3 молів ідеального газу при його нагріванні від 298 до 400 К. 10. Визначте середню молярну теплоємність NH3 в інтервалі температур від 200 до 300 К, якщо вираз для залежності його істинної теплоємності від температури в цьому температурному інтервалі має вигляд: Ср = 24,8 + 37,5 · 10–3 Т – 7,36 · 10–6 Т2 Дж/(моль · К).
Розділ IІ.
|
||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 293; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.119.149 (0.01 с.) |