
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розрахунок рівноважних концентрацій речовинСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Рівноважна концентрація йоду:
де V1 – кількість тіосульфату, витрачена на титрування йоду в момент рівноваги, мл; V2 – кількість відібраної проби, мл. 2. Концентрація Fe2+ буде дорівнювати подвоєній концентрації йоду, тому що по рівнянню реакції утворюється одна молекула йоду і два іони Fe2+, отже,
3. Концентрація Fe3+ в стані рівноваги дорівнює різниці початкової концентрації іонів Fe3+ і рівноважної концентрації Fe2+, оскільки з рівняння реакції збільшення концентрації Fe2+ дорівнює зменшенню концентрації Fe3+:
Вміст FеСl3 обчислюється з концентрації вихідного розчину і ступеня розведення його при змішуванні розчинів:
де a і b – об’єми розчинів FeCl3 і KI, взятих для проведення реакції відповідно. Концентрація іона I – обчислюється за рівнянням:
де Експериментальні і розрахункові дані записати в табл. 3.2. Таблиця 3.2 Експерементальні данні
На підставі експериментальних даних розрахувати для досліджуваних реакцій константу рівноваги Кс за рівнянням (3.1), середню константу рівноваги для двох температурах, середній тепловий ефект DН.
Контрольні питання 1. Які термодинамічні і кінетичні ознаки рівноважного стану? 2. Через які величини можна виразити константу хімічної рівноваги? Яка залежність існує між константами рівноваги, вираженими різними способами? 3. Від чого залежать Кр і Кс реакцій? 4. Як, виходячи з принципу Ле-Шательє, передбачити вплив температури на константу рівноваги? 5. Які ознаки свідчать про досягнення рівноваги? 6. Як можна змістити рівновагу при постійній температурі? Як впливає тиск, концентрації вихідних речовин і продуктів реакції на рівноважний вихід? 7. Як, на підставі експериментальних даних, визначити константи рівноваги хімічних реакцій при даних температурах? Як розрахувати тепловий ефект реакції, знаючи Кр і Кс рівноваги при різних Т? 8. У яких координатах залежність константи рівноваги від температури виражається прямою лінією? Який нахил має ця пряма у випадку зкзо- і ендотермічної реакції?
Розділ ІV ФАЗОВІ РІВНОВАГИ
Для характеристики стану сплавів широко застосовують правило фаз Гіббса, записане у формі:
де С – число ступенів свободи; К – число компонентів; Ф – число фаз.
Діаграми в координатах ”склад - температура кристалізації” (діаграми плавкості) вказують на наявність тих чи інших фаз, температуру кристалізації суміші визначеної сполуки, складу і кількості фаз при тій чи іншій температурі. Найбільш розповсюджений метод для побудови діаграм плавкості - метод термічного аналізу, в основі якого лежить спостереження за швидкістю охолодження розплавлених чистих речовин і сплавів різного складу. Якщо дві речовини змішати одну з одною у визначених пропорціях і суміш нагріти до високої температури, то в більшості випадків утвориться однорідна рідина, що представляє розчин одного компонента в іншому. Якщо такий розчин чи розплав охолоджувати, то при деякій температурі він почне кристалізуватися, тому що розчинність речовин зі зниженням температури, як правило, зменшується. Кількість речовини, що випадає, обумовлюється природою і кількісними співвідношеннями компонентів у розчині. Теплота кристалізації, що виділяється при цьому, впливає на швидкість охолодження сплаву. У деяких випадках охолодження може цілком припинитися і температура суміші протягом деякого-часу буде залишатися постійною. Таким чином, охолоджуючи даний розплав, досягають нерівномірного зменшення температури в залежності від процесів, що відбуваються в сплаві. Якщо наносити на осі ординат температуру, а на осі абсцис - час, то одержимо криві, що ілюструють процес охолодження. Вид цих кривих буде характерний як для чистих речовин, так і для сумішей різних концентрацій. У процесі кристалізації, в залежності від складу суміші, можуть випадати або тверді чисті компоненти, або тверді розчини. Діаграми плавкості розділяють на три типи в залежності від того, яка фаза виділяється з розчину. До першого типу відносяться системи, при кристалізації яких з розплавів виділяються чисті тверді компоненти, так звані неізоморфні суміші. Другий тип представляють системи, при кристалізації яких з рідких розчинів виділяються тверді розчини з необмеженою областю взаємної розчинності - ізоморфні суміші. Третій тип – системи, при кристалізації яких з рідких розчинів виділяються тверді розчини, що характеризуються визначеними областями взаємної розчинності. Розглянемо докладніше діаграми плавкості неізоморфних сумішей з простою евтектикою, оскільки досліджувана нами система нафталін - бензойна кислота кристалізується саме за таким типом.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 694; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.86.30 (0.009 с.) |

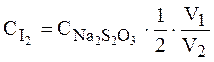
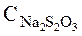 - молярність розчину тіосульфату, моль/л;
- молярність розчину тіосульфату, моль/л;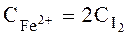 .
.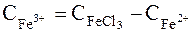 чи
чи 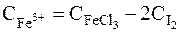
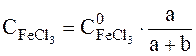
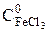 - початкова концентрація розчину FeCl3, моль/л;
- початкова концентрація розчину FeCl3, моль/л;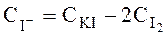 ;
; 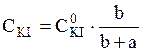
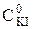 - концентрація вихідного розчину, моль/л.
- концентрація вихідного розчину, моль/л.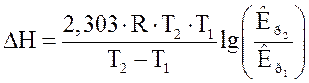 (3.4)
(3.4) (4.1)
(4.1)


