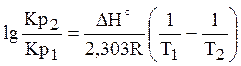Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
І встановлення його структуриСодержание книги
Поиск на нашем сайте
Ціль роботи: визначення рефракції розчиненої речовини за питомою рефракцією розчину, розчинника й відсотковому вмісту розчину, а також установлення його ймовірної структури, використовуючи властивість адитивності рефракції. Експерементальне визначення рефракції речовини зводиться до виміру показника заломлення й густини. Показник заломлення визначають за допомогою рефрактометра РЛ, вимірюючи граничний кут заломлення між рідиною й склом. Речовину поміщають між призмами (трохи крапель досліджуваного речовини наносять на нижню призму). Світло, пройшовши з нижньої призми, розглядають у полі зору окуляра. Три візирні штрихи в полі зору окуляра сполучають із границею темного й світлого полів поворотом рукоятки, показник заломлення відраховують по лівій шкалі. Границя світлотіні попередньо ахроматирується обертанням маховичка компенсатора на рукоятці окуляра. Густину рідини визначають за допомогою пікнометру. Попередньо зважений на аналітичних вагах сухий пікнометр об'ємом 5 Густину розчинів розраховують за рівнянням:
де g0, g1, g2 – маси порожнього пікнометру, пікнометру з водою й з досліджуваним розчином, г;
Визначення рефракції розчиненої речовини Рефракцію кристалічної речовини можна визначити з рефракції його розчину, тому що й тут має місце адитивність рефракції. Рефракція суміші дорівнює сумі рефракції компонентів, віднесених до їхніх часток у суміші. Особливо доцільно в цьому випадку застосування питомої рефракції r (рефракції, віднесеної до 1г речовини):
Для розчину речовини А у розчиннику В можна записати
rА,В= rАх + rВ(1-х), (2.7)
де rА, В- питома рефракція розчину; rА- питома рефракція речовини А; rВ- питома рефракція В; х – масова частка речовини А в розчині. Підставивши в рівняння х = а/100 і 1-х = (100-а)/100, де а – відсотковий вміст речовини А в розчині та вирішуючи рівняння відносно rА, одержимо
Виразивши рефракцію через показник заломлення й густину, одержимо рівняння для обчислення рефракції розчиненої речовини
Послідовність виконання роботи 1. Приготувати три розчини досліджуваної речовини (речовину, масу розчинів і відсотковий вміст розчиненої речовини вказує викладач). 2. Виміряти показник заломлення розчинника й приготовлених розчинів. 3. Визначити густину розчинів при тій же температурі, при якій були обмірювані показники заломлення. 4. Розрахувати питомі рефракції розчиненої речовини для трьох заданих розчинів і, розрахувавши середнє значення, визначити молярну рефракцію розчиненої речовини. 5. Зіставити експерементально отримане значення молярної рефракції з розрахунковим по (2.4), зробити висновок щодо можливої структури досліджуваної речовини. Отримані дані занести в табл. 2.1
Визначення рефракції органічної рідкої речовини й установлення його структури Послідовність виконання роботи 1. Виміряти показник заломлення рідкої органічної речовини (речовина видається викладачем, вказуються емпірична формула й густина). 2. Розрахувати густину розчинів. 3. Розрахувати питому рефракцію досліджуваної речовини для розчинів різних концентрацій. 4. Розрахувати середнє значення питомої рефракції досліджуваної речовини. 5. Розрахувати молярну рефракцію досліджуваної речовини.
Таблиця 2.1
6. Розрахувати по рівнянню 2.4 молярну рефракцію речовини (теоретичне значення). 7. Зіставити експерементально отриману рефракцію з розрахунковим значенням. Розрахувати відносну похибку й зробити висновок щодо структурної формули речовини.
Контрольні питання 1. Що називається поляризацією? Складові поляризації. 2. Як залежить поляризація від температури? 3. Зв'язок рефракції з поляризацією. 4. Як залежить рефракція від температури, агрегатного стану речовини, довжини хвилі видимого світла? 5. Як визначаються показники заломлення? 6. Як визначаються густини розчинів? 7. Як визначається питома рефракція розчиненої речовини? 8. Розмірність питомої й молярної рефракцій. 9. У чому полягає властивість адитивності рефракції? 10. Як за допомогою рефракції можна визначити структурну формулу речовини? Розділ IIІ ХІМІЧНА РІВНОВАГА
Хімічні реакції поділяються на гомогенні і гетерогенні. Хімічна реакція, що протікає в межах однієї фази, називається гомогенною. До гомогенних реакцій відносяться хімічні процеси, що протікають у газовій фазі і рідких розчинах. Хімічна реакція, що протікає на межі розділу фаз, називається гетерогенною. Поняття хімічної рівноваги. Розглянемо гомогенну реакцію. Речовини А і В реагують між собою за рівнянням: aА + bВ «eE + fF, де Е і F - кінцеві речовини; а, в, e, f - стехіометричні коефіцієнти. В залежності від умов дана реакція може протікати самодовільно як у прямому, так і в зворотньому напрямку. Хімічна реакція протікає самодовільно доти, доки не буде досягнено хімічної рівноваги між реагуючими речовинами. Умови хімічної рівноваги можуть визначатися термодинамічним чи кінетичним методами. Термодинамічно хімічна рівновага встановлюється як співвідношення концентрацій вихідних речовин і продуктів реакцій, при якому вільна енергія системи має мінімальне значення; кінетично хімічна рівновага визначається як стан, при якому швидкості прямої і зворотної реакцій рівні, при цьому рівновага встановлюється тоді, коли склад суміші при постійних зовнішніх умовах з часом не змінюється. Хімічна рівновага характеризується рухливістю. Якщо система, що знаходиться в рівновазі, буде в незначному ступені виведена з цього положення зовнішнім впливом (зміною температури, тиску і т.і.), то за умов припинення останнього, вона самодовільно повертається в колишній стан. Система, стан якої характеризується двома ознаками - незмінністю складу і рухливістю, називається рівноважною системою, а склад її - рівноважним складом. У складі рівноважної суміші концентрації вихідних речовин і кінцевих продуктів знаходяться у визначеному співвідношенні. Швидкість реакції прямо пропорційна концентраціям реагуючих речовин у ступенях, рівних стехіометричним коефіцієнтам, тобто у випадку даної реакції: V1 = k1 CaA CbB i V2 = k2 CeE CfF
При рівновазі V1 = V2 = k1 CaA CbB = k2 CeE CfF, звідси:
де CA, СB, CE, CF концентрації відповідних речовин; k1 і k2 - константи швидкості відповідно прямої і зворотньої реакції; КC - константа рівноваги, виражена через рівноважні молярні концентрації.
Рівновага системи може зміщуватися при зміні початкової концентрації реагуючих речовин, а константа рівноваги залишається незмінною при постійній температурі. Залежність константи рівноваги від температури виражається рівнянням ізобари хімічної реакції:
де DН° - зміна ентальпії системи.
Рис. 3.1. Залежність константи рівноваги реакції від температури
У випадку хімічних процесів зміна ентальпії системи DН відповідає тепловому ефекту реакції, якщо ця реакція проведена при постійному тиску. Знак теплового ефекту визначає знак похідної
Лабораторна робота №5
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 388; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.61.176 (0.008 с.) |

 10см3 заповнюють за допомогою спеціальної лійки дистильованою водою до мітки. Якщо рівень виявиться вище мітки, надлишкову кількість рідини видаляють фільтрувальним папером. Пікнометр із водою витримують протягом 10 хв і зважують. Аналогічно роблять заповнення й зважування пікнометру з досліджуваними розчинами.
10см3 заповнюють за допомогою спеціальної лійки дистильованою водою до мітки. Якщо рівень виявиться вище мітки, надлишкову кількість рідини видаляють фільтрувальним папером. Пікнометр із водою витримують протягом 10 хв і зважують. Аналогічно роблять заповнення й зважування пікнометру з досліджуваними розчинами. (2.5)
(2.5) - густина води (розчинника) при температурі визначення, г/см3.
- густина води (розчинника) при температурі визначення, г/см3.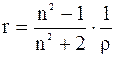 (2.6)
(2.6)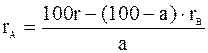 (2.8)
(2.8) (2.9)
(2.9)
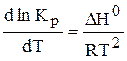

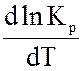 в рівнянні. Якщо DН>0, тобто хімічна реакція ендотермічна, знак похідної буде позитивний, отже, константа рівноваги зі збільшенням температури зростає. Якщо, DН<0, тобто хімічна реакція йде з виділенням теплоти, то реакція - екзотермічна; знак похідної негативний, отже, константа рівноваги зі збільшенням температури зменшується. Якщо DН=0, тобто хімічна реакція відбувається без теплового ефекту, константа рівноваги не залежить від температури (рис. 3.1). Якщо прийняти, що тепловий ефект хімічної реакції не залежить від температури, то після інтегрування рівняння ізобари одержимо рівняння:
в рівнянні. Якщо DН>0, тобто хімічна реакція ендотермічна, знак похідної буде позитивний, отже, константа рівноваги зі збільшенням температури зростає. Якщо, DН<0, тобто хімічна реакція йде з виділенням теплоти, то реакція - екзотермічна; знак похідної негативний, отже, константа рівноваги зі збільшенням температури зменшується. Якщо DН=0, тобто хімічна реакція відбувається без теплового ефекту, константа рівноваги не залежить від температури (рис. 3.1). Якщо прийняти, що тепловий ефект хімічної реакції не залежить від температури, то після інтегрування рівняння ізобари одержимо рівняння: