
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Оформлення результатів вимірюваньСодержание книги
Поиск на нашем сайте
Лабораторний практикум з дисципліни ФІЗИЧНА ХІМІЯ для студентів II і ІІІ курсу напряму підготовки: 051301 Хімічна технологія галузі знань: 0513 Хімічна технологія та інженерія (05130115– Хімічна технологія та обладнання опоряджувального виробництва
Херсон 2011
Лабораторний практикум з дисципліни Фізична хімія для студентів ІІ і ІІІ курсів напряму підготовки: 051301 Хімічна технологія галузі знань: 0513 Хімічна технологія та інженерія (05130115– Хімічна технологія та обладнання опоряджувального виробництва /Костина М.В., Семенченко О.О., Алфьорова В.П. - Херсон: Херсонський національний технічний університет, 2011р. – 100 с.
Лабораторний практикум складено відповідно до типової програми дисципліни "Фізична хімія" для студентів, що навчаються за напрямком "Хімічна технологія". У практикумі наведено лабораторні роботи з розділів «Термохімія», «Хімічна рівновага», «Фазові рівноваги» і «Розчини», «Електрохімія», «Кінетика».
Укладачі: к.т.н., доц. Костина М.В.; к.т.н., доц. Семенченко О.О. Алфьорова В.П.
Рецензенти: к.т.н., доц. Скропишева О.В. кафедри ХТДВМ ХНТУ.
Усі цитати, цифровий та фактичний матеріал, бібліографічні відомості перевірені, написання одиниць відповідає стандартам. Зауваження рецензентів враховані.
Затверджено на засіданні кафедри фізичної та неорганічної хімії протокол № 13 від 10.02.2011р. Зав.каф., д.т.н., проф. Г.В.Міщенко
Відповідальний за випуск: Міщенко Г.В. завідувач кафедри фізичної і неорганічної хімії.
Передмова Фізична хімія – наука, що пояснює і встановлює закономірності хімічних явищ на основі загальних принципів фізики та хімії. Вона охоплює всі питання теорії хімічних процесів і розглядає вплив фізичних параметрів на хімічні перетворення й хімічний склад та фізичні властивості. Закони фізичної хімії дозволяють більш глибоко зрозуміти природу та механізм хімічних реакцій, з якими безпосередньо зустрічаються дослідники та технологи на хімічному виробництві.
Методи фізичної хімії використовуються при аналізі і контролі технологічних процесів виробництва. Хімічна технологія фактично є прикладною фізичною хімією, тому в фізико-хімічній підготовці майбутнього технолога важливе місце займають лабораторні роботи. В лабораторії студент знайомиться з практичним значенням загальних теоретичних ідей, які викладаються на лекціях і в підручниках з фізичної хімії. Перед лабораторними роботами подано теоретичний матеріал, що є необхідним для розуміння суті і теоретичного обґрунтування результатів експерименту. На лабораторних заняттях студент знайомиться з принципом роботи та конструкцією приладу або пристрою, користуючись приведеними інструкціями. Допуск до виконання роботи студент одержує від викладача, що веде лабораторні роботи тільки після опитування і лише в тому випадку, якщо студент виявився підготовленим. Звіт з виконання роботи студент здає на наступному занятті, для чого здає викладачу лабораторний журнал з оформленою за вимогами роботою. При роботі в фізико-хімічній лабораторії необхідно дотримуватись правил техніки безпеки.
ОФОРМЛЕННЯ РЕЗУЛЬТАТІВ ВИМІРЮВАНЬ Дані дослідів і одержані результати розрахунків подаються у вигляді таблиць і графіків. Графіки служать для ілюстрації чи перевірки теоретичних рівнянь. Ними користуються також для складання емпіричних рівнянь у тих випадках, коли неможливо застосувати аналітичні. Таблиці обов'язково повинні мати назви і підписи, що містять короткий і точний їх опис. Складання таблиць Всі вимірювання містять щонайменше дві змінні, одну з яких обирають як незалежну (у дослідах її задають як аргумент х), а інші (інша) є залежними (функції у, z і ін.) В таблиці аргумент і функції повинні стояти в одному рядку, а кожне їх значення у своєму стовпці. Стовпець повинен мати заголовок, що вказує назву й одиницю вимірювання приведеної в ньому величини. За незалежні змінні приймають такі величини, як час, температура, тиск, концентрація і т.п. При складанні таблиці значення аргументу і відповідних функцій розташовують у порядку зростання чи зменшення. При заповненні таблиці значення повинні бути розташовані так, щоб коми, що відокремлюють десяткові знаки, були розташовані в кожнім стовпці на одній вертикалі.
Кожне число у таблиці повинне містити не більше і не менше значущих цифр, чим дозволяє точність досліджених даних. Числа, отримані як середнє з декількох досліджених даних чи розрахунковим шляхом, варто округляти так, щоб остання цифра в числі була першою сумнівною цифрою. Як зразок оформлення, наведено табл.1 і 2: Таблиця 1. Побудова графіків Графічне зображення експериментальних і розрахункових даних полегшує порівняння величин, дозволяє легко знайти характер зміни величин — наявність екстремальних точок чи точок перегину, періодичність, поява граничних значень та інші важливі властивості. У таблицях ці особливості виявляються менш чітко. Нарешті, за допомогою графіків можна робити диференціювання й інтегрування, навіть не знаючи математичної форми представленої графічної залежності. При побудові графіків необхідно дотримуватись наступних правил. Значення незалежної змінної (аргументу) відкладають по осі абсцис, функції - по осі ординат. Яку з двох змінних вважати незалежною, випливає звичайно з експерименту. Якщо, в ході досліду значення однієї змінної встановлюють довільно, а відповідні значення інших змінних виявляються при цьому цілком визначеними, то перша змінна і вважається незалежною. Загального правила для вибору аргументу не існує. В и б і р м а с ш т а б у. І. Масштаб потрібно обирати так, щоб координати будь-якої точки графіка могли бути визначені швидко і легко. Якщо на розграфленому в клітинку папері (міліметровому) відстань між двома головними сусідніми лініями розділено на десять рівних частин, то найбільш зручно вибирати такий масштаб, при якому ця відстань прийнята за 1, 2 чи 5 одиниць, або за ці значенняпомножені на 10± n, де n — ціле число. Масштаб, при якому читання графіка утруднене, не може вважатися прийнятним (порівняйте рис.1 а і 1 б, що є прикладами зручного і незручного вибору масштабів). Не всі лінії координатної сітки повинні бути надписані; часто для читання графіка виявляється зручним надписувати лінії через одну.
Рис. 1. Залежність логарифма тиску насиченої пари дифенілу від зворотної температури, побудована у (а) правильно і (б) неправильно вибраних масштабах.
Але яка б система надпису позначень не була прийнята, вона повинна бути дотримана на всьому графіку. Доцільно, щоб числа, проставлені на осі, містили стільки значущих цифр, скільки допускає точність даних чи скільки можна прочитати по кривій (рис.1а). Для зручності користування графіком необхідно проставити на кожній координатній осі назву величини, що представляється нею, і одиниць, у яких вона вимірюється.
Рис. 2 Залежність питомої провідності соляної кислоти від концентрації, побудована в (а) правильно і (б) неправильно вибраних масштабах
II. Масштаб слід обирати так, щоб похибка вимірювань відповідала похибці на графіку не більш, ніж в одну-дві найменших поділок масштабу. При виборі шкали по осі координат немає необхідності обов'язково починати з нульового значення, якщо це не викликано спеціальними міркуваннями (необхідність екстраполяції і т.п.). Відповідно до цього правила, шкала для кожної змінної може починатися з найменшого округленого значення із сукупності даних чи трохи нижче і закінчуватися найбільшим округленим значенням чи трохи вище (рис.2).
III. Якщо графік використовують для визначення коефіцієнтів рівняння, що виражає залежність у = f(x),або для екстраполяції отриманої залежності, варто вибирати таку функціональну залежність, при якій зменшується кривизна ліній (звичайну логарифмічну, показову з дробовим показником ступеня та ін.). IV. Масштаб повинен бути обраний так, щоб крива, наскільки це можливо, була нахилена до осі абсцис під кутом, близьким до 45°. При необхідності підкреслити характерні риси в зміні функції (наявність екстремальних точок, точок перегину і т.п.) варто відносно збільшити масштаб функції і зменшити масштаб аргументу (рис. 2 а і 2 б; максимум питомої електропровідності в першому випадку виражений більш чітко). Розділ І ТЕРМОХІМІЯ
Термохімія вивчає теплові ефекти хімічних реакцій. У багатьох випадках ці реакції протікають при постійному об'ємі чи постійному тиску. З першого закону термодинаміки:
випливає, що при даних умовах теплота є функцією стану. При постійному об'ємі теплота дорівнює зміні внутрішньої енергії:
а при постійному тиску – зміні знтальпії:
Ці рівності при застосуванні до хімічних реакцій виражають суть закону Гесса: Лабораторна робота №1 Завдання. 1. Визначити зміну температури в калориметрі в результаті розчинення певної наважки KCl. 2. Обчислити моляльну концентрацію розчину і за табличними даними визначити кількість теплоти, що виділилася. 3. Обчислити теплову сталу калориметра.
Виконання роботи. Ретельно розтерти в фарфоровій ступці 6 г калій хлориду. Зважити з точністю до 0,001г порожню пробірку з пробкою, висипати в неї наважку солі і знову зважити. По різниці обчислити наважку. Зважити в калориметричну склянку чи в посудину Дьюара 300 г дистильованої води (з точністю до 0,1 г). Зібрати калориметр, закрити його кришкою, вставити в неї пробірку так, щоб низ пробірки був покритий водою. В другий отвір опустити термометр Бекмана. Перед початком роботи перевірити настройку термометра, опустивши його в розчин у калориметрі. Кінець стовпчика ртуті повинен встановитися біля середини шкали. Записати показання термометра в попередньому періоді. Після десятого відліку висипати сіль у воду і зважити пробірку. При розчиненні солі температура падає, потім починає рівномірно зростати. Початок підвищення температури відповідає кінцю головного періоду. Визначити графічно DT і обчислити теплову сталу Ck за рівнянням (1.18). Інтегральна теплота розчинення калій хлориду (DН, кДж/моль) визначається за табличними даними (додаток табл.7), для цього заздалегідь розрахувати концентрацію розчину
g1 – маса речовини (солі), г; g2 – маса розчинника, г; М – молекулярна маса речовини, г/моль. Результати вимірювань записати в табл. 1.1:
Таблиця 1.1 Лабораторна робота №2 КУПРУМ (II) СУЛЬФАТУ
Завдання: 1. Визначити інтегральну теплоту розчинення безводної солі та кристалогідрату і по різниці обчислити теплоту утворення кристалогідрату. Виконання роботи. Теплову сталу калориметра розрахувати, як зазначено в роботі 1. Зібрати прилад (рис.1.1). Мідний купорос CuSO4×5H2O подрібнити у фарфоровій ступці. Близько 7,5 г його зважити з точністю до 0,1 г і помістити в зважену пробірку. Пробірку з сіллю зважити з точністю до 0,001 г. По різниці з порожньою пробіркою обчислити наважку. В склянку відважити 300 г води з точністю до 0,01 г. Реакція йде з поглинанням тепла. Вимірювання і запис результатів аналогічні роботі 1. По формулі (1.17) розрахувати DН2. Близько 10 г мідного купоросу роздрібнити в фарфоровій чашці і нагріти, помішуючи, поки не утвориться біла безводна сіль. Отриману сіль негайно пересипати в пробірку і закрити гумовою пробкою і охолодити. Взяти наважку 4,5 г безводної солі і провести вимірювання аналогічно першому. Вимірювання і запис результатів аналогічні роботі 1. По формулі (1.17) розрахувати DН1. Зіставити експерементально отримані теплоти розчинення з довідковими значеннями (додаток табл.7). Розрахувати відносну похибку. Теплоту гідратоутворення (∆Hгідр.)Дж/моль, розрахувати за формулою: ∆Hгідр.= DН1 - DН2
Лабораторна робота №3 Рефрактометрія
2.I. Поляризація молекул Усі молекули можуть бути розділені на два типи: неполярні й полярні (з несиметричним і симетричним розподілом зарядів). Полярну молекулу називають також дипольною, або диполем. У двохатомному диполі на одному з атомів утворюється надлишок негативних, на іншому – такий же надлишок позитивних зарядів. У багатоатомних молекул існують деякі області з надлишком позитивних і негативних зарядів. Однак і тут можна уявити собі два центри зарядів. Дипольним моментом μ називають добуток заряду на відстань між зарядами. Дипольний момент має властивості векторів. При поміщенні неполярної молекули в електричне поле під дією електричного поля сусідньої полярної молекули або йона атоми й легкорухливі електрони перетерплюють деякі зміни, відбувається зсув зарядів відносно один одного, що створює індукований (наведений) дипольний момент. Внаслідок існування власного (постійного) дипольного моменту полярна молекула прагне орієнтуватися уздовж напрямку поля, крім того, в ній, як і в неполярній виникає наведений момент. Зсув електронів, атомів, орієнтація молекули в електричнім полі називається поляризацією. Поляризація молекули Р складається з електронної Рел, атомної Рат і орієнтаційної Рор. Р = Рел+ Рат + Рор (2.1) Електронна й атомна поляризація не залежить від температури, орієнтаційна – обернено пропорційна абсолютній температурі, тому що хаотичний тепловий рух молекул порушує орієнтацію
де ε – відносна діелектрична проникність, М – молярна маса (г), ρ – густина речовини (г/см3), М/ρ – молярний об'єм (см3/моль). При зміні напрямку зовнішнього електричного поля відбувається переорієнтація полярних молекул і зміна напрямку вектора наведеного диполя. При збільшенні частоти електричного поля спочатку відпадає орієнтаційна (при ν ~1010 Гц, λ ~ 1см), потім атомна (при ν ~ 1013 Гц, λ ~ 10-4 см) складові поляризації, тому що молекули й атоми, що мають порівняно більшу масу, не встигають за зміною напрямку електричного поля, і залишається тільки електронна поляризація. 2.2 Молярна рефракція. При частотах видимого світла порядку 1015 Гц (λ= 450-750нм) проявляється тільки електронна поляризація Рел, яку називають молярною рефракцією R, см3/моль
де n – показник заломлення для променів видимого світла. Згідно зі співвідношенням Максвелла, при нескінченно великій довжині хвилі ε = n2∞, але для наближених визначень рефракції досить користуватися показником заломлення променів видимого світла. За стандарт обрана жовта лінія натрію (позначають символом D, довжина хвилі λD=589,3 нм). У довідкових таблицях усі дані, як правило, наведені для цієї довжини хвилі. Експерементально встановлено, що рефракція молекули наближено є сумою рефракцій окремих йонів, атомів або зв'язків, що входять до неї. Цю властивість рефракції (адитивність) можна пояснити тим, що зсув електронів у молекулі мало залежить від того, у які молекули входять такі групи. Крім того, зсув електронів незначно змінюється з температурою й агрегатним станом речовини. У речовин з однаковою емпіричною формулою, але різною будовою, рефракції різні. Наявність у сполуках кратних зв'язків і напружених циклів, що утворюються за рахунок π-зв'язків з легкорухливими електронами, збільшує їхню молярну рефракцію.
R = ΣmRат + ΣmRкр.зв. + ΣmRциклів (2.4)
де m – число атомів, кратних зв'язків, циклів. Адитивність рефракції дозволяє встановити структуру молекули шляхом добору такої структурної формули, для якої вирахована молекулярна рефракція за наведеним рівнянням дорівнює експерементально отриманому значенню.
Лабораторна робота №4. Розділ IIІ ХІМІЧНА РІВНОВАГА
Хімічні реакції поділяються на гомогенні і гетерогенні. Хімічна реакція, що протікає в межах однієї фази, називається гомогенною. До гомогенних реакцій відносяться хімічні процеси, що протікають у газовій фазі і рідких розчинах. Хімічна реакція, що протікає на межі розділу фаз, називається гетерогенною. Поняття хімічної рівноваги. Розглянемо гомогенну реакцію. Речовини А і В реагують між собою за рівнянням: aА + bВ «eE + fF, де Е і F - кінцеві речовини; а, в, e, f - стехіометричні коефіцієнти. В залежності від умов дана реакція може протікати самодовільно як у прямому, так і в зворотньому напрямку. Хімічна реакція протікає самодовільно доти, доки не буде досягнено хімічної рівноваги між реагуючими речовинами. Умови хімічної рівноваги можуть визначатися термодинамічним чи кінетичним методами. Термодинамічно хімічна рівновага встановлюється як співвідношення концентрацій вихідних речовин і продуктів реакцій, при якому вільна енергія системи має мінімальне значення; кінетично хімічна рівновага визначається як стан, при якому швидкості прямої і зворотної реакцій рівні, при цьому рівновага встановлюється тоді, коли склад суміші при постійних зовнішніх умовах з часом не змінюється. Хімічна рівновага характеризується рухливістю. Якщо система, що знаходиться в рівновазі, буде в незначному ступені виведена з цього положення зовнішнім впливом (зміною температури, тиску і т.і.), то за умов припинення останнього, вона самодовільно повертається в колишній стан. Система, стан якої характеризується двома ознаками - незмінністю складу і рухливістю, називається рівноважною системою, а склад її - рівноважним складом. У складі рівноважної суміші концентрації вихідних речовин і кінцевих продуктів знаходяться у визначеному співвідношенні. Швидкість реакції прямо пропорційна концентраціям реагуючих речовин у ступенях, рівних стехіометричним коефіцієнтам, тобто у випадку даної реакції: V1 = k1 CaA CbB i V2 = k2 CeE CfF
При рівновазі V1 = V2 = k1 CaA CbB = k2 CeE CfF, звідси:
де CA, СB, CE, CF концентрації відповідних речовин; k1 і k2 - константи швидкості відповідно прямої і зворотньої реакції; КC - константа рівноваги, виражена через рівноважні молярні концентрації.
Рівновага системи може зміщуватися при зміні початкової концентрації реагуючих речовин, а константа рівноваги залишається незмінною при постійній температурі. Залежність константи рівноваги від температури виражається рівнянням ізобари хімічної реакції:
де DН° - зміна ентальпії системи.
Рис. 3.1. Залежність константи рівноваги реакції від температури
У випадку хімічних процесів зміна ентальпії системи DН відповідає тепловому ефекту реакції, якщо ця реакція проведена при постійному тиску. Знак теплового ефекту визначає знак похідної
Лабораторна робота №5 Експерементальні данні
На підставі експериментальних даних розрахувати для досліджуваних реакцій константу рівноваги Кс за рівнянням (3.1), середню константу рівноваги для двох температурах, середній тепловий ефект DН.
Контрольні питання 1. Які термодинамічні і кінетичні ознаки рівноважного стану? 2. Через які величини можна виразити константу хімічної рівноваги? Яка залежність існує між константами рівноваги, вираженими різними способами? 3. Від чого залежать Кр і Кс реакцій? 4. Як, виходячи з принципу Ле-Шательє, передбачити вплив температури на константу рівноваги? 5. Які ознаки свідчать про досягнення рівноваги? 6. Як можна змістити рівновагу при постійній температурі? Як впливає тиск, концентрації вихідних речовин і продуктів реакції на рівноважний вихід? 7. Як, на підставі експериментальних даних, визначити константи рівноваги хімічних реакцій при даних температурах? Як розрахувати тепловий ефект реакції, знаючи Кр і Кс рівноваги при різних Т? 8. У яких координатах залежність константи рівноваги від температури виражається прямою лінією? Який нахил має ця пряма у випадку зкзо- і ендотермічної реакції?
Розділ ІV ФАЗОВІ РІВНОВАГИ
Для характеристики стану сплавів широко застосовують правило фаз Гіббса, записане у формі:
де С – число ступенів свободи; К – число компонентів; Ф – число фаз.
Діаграми в координатах ”склад - температура кристалізації” (діаграми плавкості) вказують на наявність тих чи інших фаз, температуру кристалізації суміші визначеної сполуки, складу і кількості фаз при тій чи іншій температурі. Найбільш розповсюджений метод для побудови діаграм плавкості - метод термічного аналізу, в основі якого лежить спостереження за швидкістю охолодження розплавлених чистих речовин і сплавів різного складу. Якщо дві речовини змішати одну з одною у визначених пропорціях і суміш нагріти до високої температури, то в більшості випадків утвориться однорідна рідина, що представляє розчин одного компонента в іншому. Якщо такий розчин чи розплав охолоджувати, то при деякій температурі він почне кристалізуватися, тому що розчинність речовин зі зниженням температури, як правило, зменшується. Кількість речовини, що випадає, обумовлюється природою і кількісними співвідношеннями компонентів у розчині. Теплота кристалізації, що виділяється при цьому, впливає на швидкість охолодження сплаву. У деяких випадках охолодження може цілком припинитися і температура суміші протягом деякого-часу буде залишатися постійною. Таким чином, охолоджуючи даний розплав, досягають нерівномірного зменшення температури в залежності від процесів, що відбуваються в сплаві. Якщо наносити на осі ординат температуру, а на осі абсцис - час, то одержимо криві, що ілюструють процес охолодження. Вид цих кривих буде характерний як для чистих речовин, так і для сумішей різних концентрацій. У процесі кристалізації, в залежності від складу суміші, можуть випадати або тверді чисті компоненти, або тверді розчини. Діаграми плавкості розділяють на три типи в залежності від того, яка фаза виділяється з розчину. До першого типу відносяться системи, при кристалізації яких з розплавів виділяються чисті тверді компоненти, так звані неізоморфні суміші. Другий тип представляють системи, при кристалізації яких з рідких розчинів виділяються тверді розчини з необмеженою областю взаємної розчинності - ізоморфні суміші. Третій тип – системи, при кристалізації яких з рідких розчинів виділяються тверді розчини, що характеризуються визначеними областями взаємної розчинності. Розглянемо докладніше діаграми плавкості неізоморфних сумішей з простою евтектикою, оскільки досліджувана нами система нафталін - бензойна кислота кристалізується саме за таким типом. І3 ПРОСТОЮ ЕВТЕКТИКОЮ
Діаграми плавкості цього типу найбільш поширені та характерні для бінарних систем неізоморфних речовин, що не утворюють хімічних сполук, наприклад, свинець—сурма, калію хлорид— літію хлорид, а-нафтол—нафталін, фенол—метиламін, камфора—бензойна кислота, аспірин—фенацетин та ін. Фігуративні точки tA та tB на діаграмі плавкості (рис. 4.1) відповідають температурам плавлення (кристалізації) чистих компонентів А та В. У відповідності із законом Рауля, при додаванні компонента В до А температура кристалізації А знижується. Аналогічно при додаванні А до В знижується температура кристалізації В. Лінії tAE та tBE називають лініями ліквідусу. На відміну від чистих компонентів бінарні суміші кристалізуються (плавляться) не при сталій температурі, а у певному інтервалі температур, який визначається складом системи. Найнижча температура, при якій закінчується кристалізація розплаву будь-якого складу (або починається плавлення суміші), називається евтектичною температурою tE. Лінія CD, яка відповідає евтектичній температурі, нижче якої не може існувати рідка фаза, називається лінією солідусу. Точку перетину ліній ліквідусу tAE та tBE з лінією солідусу CD називають евтектичною (точка E), а розплав, склад якого відповідає точці х3 — евтектичним розплавом (він насичений, відносно обох компонентів). Суміш дрібних кристалів компонентів А та В, яка утворюється при охолодженні цього розплаву, називається евтектичною, або евтектикою.
Рис. 4.1. Побудова діаграми плавкості з простою евтектикою за кривими охолодження
Складові частини евтектики добре видно під мікроскопом. Їх можна відділити одну від одної механічним шляхом або за допомогою розчинників. Як зазначено вище, для систем, що складаються із розплавлених та твердих речовин, паровою фазою та параметром тиску можна знехтувати і тоді правило фаз Гіббса записується так: С = К — Ф + 1. У відповідності з цим рівнянням для точок на кривих плавлення число ступенів свободи дорівнює одиниці, тобто довільно та у невеликих межах можна змінювати лише одну змінну, щоб не порушити рівноваги у системі. Друга змінна при цьому змінюється у функціональній залежності від першої. В точці перетину кривих плавлення, тобто в евтектичній точці Е, в рівновазі перебувають три фази — дві тверді та розплав, а тому С = 0. В полі 1 С = 2, довільно та у невеликих межах можна змінювати обидва параметри, не змінюючи числа та вигляду фаз, які перебувають у рівновазі, тому що зміна складу розплаву не розглядається як зміна вигляду цієї фази. Поле II відповідає умовам (t, с), за яких співіснують твердий компонент А та розплав із А і В, а поле III — розплав із А і В та твердий компонент В. Діаграма стану дозволяє у будь-якій точці О (рис. 4.1) визначити не лише число рівноважних фаз і їх склад, але й маси рівноважних фаз за допомогою правила важеля. Для цього проводять через точку О горизонтальну лінію MN, яка називається конодою, або нодою. За точками М і N визначають склад рівноважних фаз. Фігуративній точці О в полі II відповідає система, що містить х1% компоненту В. При температурі t1 вона складається з двох рівноважних фаз: кристалів компонента А (точка М) і розплаву (точка N, х2% компоненту В). Загальний матеріальний баланс можна представити у вигляді рівняння m0 = m1 + m2, де m0 — маса всієї системи; т1 і т2 — маса кристалів і розплаву відповідно. Матеріальний баланс компоненту В описується рівнянням:
Підставимо значення т0 і одержимо:
Таким чином, кількості твердої і рідкої фаз обернено пропорційні довжинам відрізків ОМ i ON. Розглянемо один із способів побудови діаграм плавкості. Речовини А та В, з яких утворена дана система, а також ряд сумішей цих речовин різного складу розплавляють. Потім кожний з одержаних розплавів охолоджують та вимірюють його температуру за допомогою точного термометра або термопари через певні та невеликі проміжки часу. Одержані дані представляють у вигляді графіка в координатах температура — час. Запис кривих охолодження може бути здійснено автоматично. Якщо при охолодженні (нагріванні) в системі відбуваються фазові перетворення (наприклад, випадіння твердої фази з рідини, перехід однієї поліморфної модифікації в іншу), то теплота, яка виділяється (поглинається) при перетворенні, змінює швидкість спадання (зростання) температури системи, що приводить до зміни кутового коефіцієнта кривої температура — час. Тому у проміжки часу, які відповідають температурам фазових перетворень, на кривих охолодження з'являються злами або горизонтальні ділянки. Розглянемо процес охолодження сумішей різного складу. Криві охолодження А та В (рис. 4.1) належать відповідним чистим компонентам, а криві 1, 2, 3, 4, 5 — сумішам складу x1, x2, x3, x4, x5, в яких вміст компонента В поступово збільшується. Криві охолодження А та В починаються похилими лініями, які відповідають охолодженню розплавів чистих компонентів до температури їх кристалізації, горизонтальні ділянки відображають процеси кристалізації компонентів А та В, тому що теплота кристалізації, яка виділяється, практично компенсує втрату тепла у навколишнє середовище. Потім ідуть похилі лінії, які характеризують швидкість охолодження затверділих чистих речовин. Крива 3 відображає процес охолодження евтектичної суміші (евтектичний склад х3). Горизонтальна ділянка на цій кривій вказує на значне виділення тепла при сталій температурі, що можна пояснити тільки повним затвердінням розплаву та перетворенням його у тверду евтектику такого ж складу. Злами на кривих 1 та 2 відповідають температурам кристалізації компоненту А з розплавлених сумішей складу x1 та х2, в яких вміст А більший, ніж в евтектиці. Тут не спостерігається повної зупинки температури, бо по мірі кристалізації компоненту А розплав збагачується компонентом В, що призводить до подальшого зниження температури кристалізації А та потребує для його виділення ще більшого охолодження розплаву. Другі (горизонтальні) зупинки температури на кривих 1, 2 пояснюються тим, що у результаті кристалізації компоненту А склад розплаву стає евтектичним і він повністю кристалізується. Аналогічно пояснюється хід кривих 4, 5. Але у розплавах складу х4 і x5 надлишком (у порівнянні з його вмістом у евтектиці) є компонент В і тому злами на кривих відповідають початку його кристалізації із відповідних розплавів. Горизонтальні ділянки на цих кривих, як і на кривих 1, 2, 3, відображають процес затвердіння евтектики. За допомогою отриманих кривих охолодження будують діаграму плавкості з простою евтектикою, як показано на рис. 4.1. Температура на обох осях ординат повинна бути відкладена у однаковому масштабі. Обладнання для визначення температур кристалізації Термічний аналіз системи нафталін - бензойна кислота виконується на установці, схема якої зображена на рис.3.2.
Рис. 4.2. Схема установки для визначення температур кристалізації: 1 – хромелевий дріт термопари; 2 – алюмелевий дріт термопари; 3 – гарячий спай термопари; 4 – ізолююча фарфорова трубка; 5 – скляний чохол для термопари; 6 – фарфоровий тигель з досліджуваним розплавом; 7 – вогнетривкий (шамотний) тигель, наповнений піском; 8 – холодний спай термопари; 9 –посудина Дьюара; 10 – електронний автоматичний потенціометр. Термопара. Температуру вимірюють за допомогою термопари, що складається з хромелевого і алюмелевого дротів, кінці яких з однієї сторони зварюють (гарячий спай) (рис.4.2). Типи термопар наведено в табл. 4.1. Таблиця 4.1 Типи термопар
Дроти ізолюють один від одного фарфоровою чи скляною трубкою. Термопару вміщують у скляний чохол у вигляді пробірки. Спай при цьому не повинен торкатися дна і бічних стінок чохла. Вільні кінці дротів (холодний кінець термопари) повинні знаходитися при постійній температурі, для цього їх поміщають у посудину Дьюара, або в лід, що тане. Термо ЕРС, що виникає між гарячим і холодним спаями, для термопар ТХ і ТХК у першому наближенні пропорційна різниці температур між ними і вимірюються електронним автоматичним потенціометром (ЕПП) і записується на стрічковій діаграмі друкуючою кареткою. Шкала приладу довжиною 275 мм градуйована в абсолютних мілівольтах і відповідає 11,8 мВ. Показання приладу розраховують за допомогою покажчика. Термопара повинна бути проградуйована в умовах, близьких до умов досліду по точках плавлення (чи кипіння) чистих речовин. У цьому випадку потрібно скористатися кривими охолодження нафталіну і бензойної кислоти, температури плавлення яких відомі: Тпл.нафталіну = 80,1°С; Тпл.бензойної кислоти= 122,5°С. Як третю точку бе
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 285; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.101.22 (0.017 с.) |





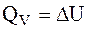
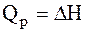
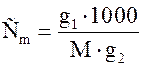 (1.19)
(1.19)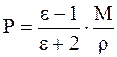 , (2.2)
, (2.2)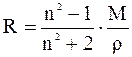 (2.3)
(2.3)
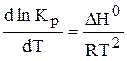

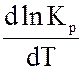 в рівнянні. Якщо DН>0, тобто хімічна реакція ендотермічна, знак похідної буде позитивний, отже, константа рівноваги зі збільшенням температури зростає. Якщо, DН<0, тобто хімічна реакція йде з виділенням теплоти, то реакція - екзотермічна; знак похідної негативний, отже, константа рівноваги зі збільшенням температури зменшується. Якщо DН=0, тобто хімічна реакція відбувається без теплового ефекту, константа рівноваги не залежить від температури (рис. 3.1). Якщо прийняти, що тепловий ефект хімічної реакції не залежить від температури, то після інтегрування рівняння ізобари одержимо рівняння:
в рівнянні. Якщо DН>0, тобто хімічна реакція ендотермічна, знак похідної буде позитивний, отже, константа рівноваги зі збільшенням температури зростає. Якщо, DН<0, тобто хімічна реакція йде з виділенням теплоти, то реакція - екзотермічна; знак похідної негативний, отже, константа рівноваги зі збільшенням температури зменшується. Якщо DН=0, тобто хімічна реакція відбувається без теплового ефекту, константа рівноваги не залежить від температури (рис. 3.1). Якщо прийняти, що тепловий ефект хімічної реакції не залежить від температури, то після інтегрування рівняння ізобари одержимо рівняння: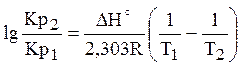
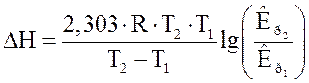 (3.4)
(3.4) (4.1)
(4.1)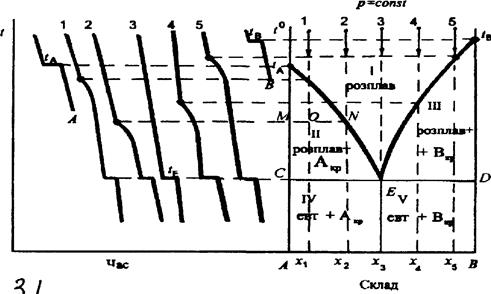


 або
або 




