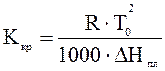Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вивчення процесу екстрагуванняСодержание книги
Поиск на нашем сайте
Завдання. Визначити кількість витягнутої речовини при однократному і багаторазовому витягу тим самим об'ємом розчинника. Виконання роботи. Відміряти по 5мл 0,05н. розчину йоду в бензолі в дві ділильні лійки на 100мл. У першу додати 45мл, у другу 15мл дистильованої води. Після інтенсивного струшування в апараті (30хв.) і розшарування розчинів (20хв.) злити водні шари в колби. В другу лійку додати до бензольного шару, що залишився, ще 15мл води. Знову струснути і витримати. Після зливання водного шару знову додати 15мл води. Визначити концентрацію рівноважних водних і бензольних шарів титруванням 0,01н. Na2S203. Бензольний розчин із другої лійки титрувати після останнього витягу. Водні шари з другої лійки після третього витягу злити разом і відтитрувати. За результатами титрування шарів з першої лійки розрахувати коефіцієнт розподілу К за рівнянням (5.1). За рівнянням (5.6) розрахувати кількість речовини, що залишилася, при однократному і багаторазовому витягу. Порівняти розраховані і дослідні дані і зробити висновок про оптимальні умови екстрагування. Контрольні питання 1. Дайте визначення закону розподілу. 2. Чим пояснюється відхилення від закону розподілу? 3. В чому полягає процес екстрагування, теоретичне пояснення? 4. Як вести процес екстрагування, щоб досягти більшої повноти витягу речовини, що екстрагується, визначеним об'ємом екстрагуючої речовини? 5. Чим визначається число порцій екстрагуючої речовини? Кріоскопія, ебуліоскопія В стані рівноваги між рідиною і парою кількість молекул, що випаровується в одиницю часу дорівнює кількості, що конденсується. Якщо в леткій рідині розчинити невелику кількість будь-якої нелеткої речовини, то концентрація молекул розчинника зменшиться, відповідно до цього зменшиться і кількість молекул, що випаровуються, тобто тиск насиченої пари. Відповідно до закону Рауля, при постійній температурі відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини:
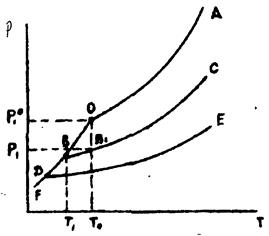
де Р10 і Р1 - тиск насиченої пари над чистим розчинником і розчином; N2 - мольна частка розчиненої речовини. Співвідношення між тиском насиченої пари і температурою для розчинника і розчинів різної концентрації показано на рис. 5.1. Крива ОА виражає залежність від температури тиску насиченої пари над чистим розчинником, криві ВС і ДЕ - тиск пари розчинника над розчинами нелеткої речовини різної концентрації. Чим вище концентрація розчиненої речовини, тим нижче тиск пари над розчином при даній температурі.
Рис. 5.1. Залежність тиску насиченої пари над розчинником і розчинами від температури
Крива OF показує залежність тиску насиченої пари над твердою фазою від температури. Крива OF завжди крутіше, ніж крива ОА, тому що теплота сублімації більше теплоти випаровування. Точка замерзання рідини характеризується рівноважним існуванням рідкої, кристалічної і газової фаз, при цьому тиск насиченої пари над рідкою і кристалічною фазами повинен бути рівний, тобто точка замерзання розчинника повинна лежати на перетині кривих FO і ОА. При замерзанні розведеного розчину з нього викристалізовується чистий розчинник. У точці замерзання повинні бути рівні тиски пари над розчином і над кристалічним розчинником (у випадку водного розчину - над льодом). При температурі замерзання чистого розчинника Т0 тиск пари над розчином Р1 (точка В¢) нижче, ніж над твердим розчинником Р10 (точка О), і рівноваги немає. Рівновага може бути досягнута лише при більш низькій температурі — в точці перетину кривої ВР із кривої FO (точка В). Чим вище концентрація розчиненої речовини, тим нижче температура замерзання розчину (точка Д). При виділенні з розчину кристалів розчинника концентрація розчиненої речовини в розчині підвищується, а температура замерзання розчину все більш знижується. Зниження температури замерзання прямо пропорційно зниженню тиску пари, що за законом Рауля пропорційно концентрації розчиненої речовини:
де q0 і q1 - маси розчинника і розчиненої речовини; М - молярна маса розчиненої речовини.
Кріоскопічна стала (константа замерзання) Ккр є величиною, характерною для даного розчинника, яка залежить від природи розчиненої речовини. Фізичний зміст її пояснюється наведеним рівнянням: Ккр - це зниження температури замерзання розчину, що містить 1 моль речовини в 1000 г розчинника, за умови, що розчин цієї концентрації має властивості ідеального, і розчинена речовина не дисоціює і не асоціює. Для експериментального визначення слід виміряти зниження температури замерзання розведених розчинів, а потім перерахувати ці дані на 1 моль. Ккр можна обчислити теоретично, знаючи температуру замерзання чистого розчинника Т0 (Тводи = 273,15 К) і його питому теплоту плавлення за рівнянням ∆Н*пл / ∆Нпл.льоду = 333,34 Дж/г
де R = 8,314 Дж/моль×К, К кр.води = 1,86.
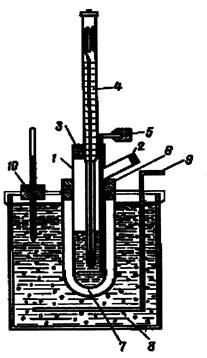
Якщо розчинена речовина розпадається в розчині на йони, то число частинок у розчині збільшується. Тому зниження тиску пари, підвищення температури кипіння і зниження температури замерзання в розчині електроліту більше, ніж у розчині неелектроліту з такою ж молярною концентрацією. Для кріоскопічних вимірювань застосовують прилад, запропонований Бекманом, схему якого наведено на рис.5.2. Прилад складається зі скляної широкогорлої пробірки 1 для розчинника. У верхній частині її роблять відросток 2 для внесення речовини, що розчиняється. Пробірку закривають корковою пробкою 3, в яку вставлено термометр Бекмана 4 і латунну мішалку 5. За допомогою гумової прокладки 6 пробірку вміщують у повітряну скляну муфту 7, що занурюють у кріостат 8. Кріостат являє собою товстостінну скляну чи металеву банку, наповнену охолоджувальною сумішшю (лід + сіль), всередині якої встановлено мішалку 9 і термометр.
Рис. 5.2. Схема приладу для визначення температури замерзання
Попередньо декілька разів визначають температуру замерзання розчинника, потім, після внесення визначеної кількості розчиненої речовини в даний розчинник — температуру замерзання отриманого розчину. Процес кристалізації чистого розчинника, починаючи з появи першого кристалика до повного затвердіння всієї рідини, протікає при постійній і визначеній температурі. Кріоскопічний метод застосуємо до сильно розведених розчинів бінарних неізоморфних систем. Отже, при затвердінні такого розчину спочатку випадають кристали чистого розчинника і розчин стає більш концентрованим, а температура кристалізації більш низькою. Тому, при визначенні температури затвердіння розчину, слід визначати температуру початку кристалізації. Іноді рідина може переохолодитися і фактично кристалізація почнеться при більш низькій температурі, що приводить до помилки у вимірюванні величини DТзам. Для більш точного визначення істинної температури початку кристалізації не можна сильно переохолоджувати розчин. Кількість розчинника, що відмірюють з бюретки чи відважують на аналітичних вагах, повинна бути такою, щоб у пробірці вона могла покрити всю голівку термометра Бекмана. Кількість розчину чи розчинника звичайно беруть близько 20 мл. На пробірку з розчинником надягають повітряну муфту, після чого пробірку вставляють у приготовлену охолоджувальну суміш і дають розчиннику охолонути, а в цей час настроюють термометр Бекмана.
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 267; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.10.117 (0.006 с.) |




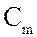 - молярна концентрація, рівна
- молярна концентрація, рівна 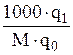 ;
;