

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Вычисления при прямом методе титрования
Похожие статьи вашей тематики
В случае прямого титрования определяемое ЛВ непосредственно вступает в реакцию с титрованным раствором (титрантом) и является титруемым веществом.
Основным уравнением для определения концентрации (С) ЛВ в процентах (массовых или массо-объемных) при использовании прямого метода титрования является уравнение:
 (1), (1),
где V – объем титрованного раствора, (мл);
Т – титр рабочего (титрованного) раствора по определяемому веществу, (г/мл);
К – поправочный коэффициент титрованного раствора;
а – навеска (г) или объем (мл) анализируемого ЛС.

Титр рабочего (титрованного) раствора (А) по определяемому веществу (Б) рассчитывают по формуле:
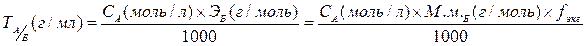 (2), (2),
где СА – молярная концентрация титранта (моль/л);
ЭБ – молярная масса эквивалента определяемого вещества (г/моль);
М.м.Б – молекулярная масса определяемого вещества (г/моль);
fэкв - фактор эквивалентности определяемого вещества в химической реакции;
1000 – коэффициент перевода величины концентрации из размерности моль/л в размерность - моль/мл.

| Титрованными растворами называются растворы точно известной концентрации, предназначенной для целей титриметрического анализа (ГФ РФ, изд. XII).
Титр титранта по определяемому веществу (ТА/Б) – выраженная в граммах масса определяемого вещества, эквивалентная одному миллилитру титранта.
ТА/Б вычисляют, исходя из молярности титранта с учетом стехиометрических коэффициентов уравнения химической реакции, протекающей при титровании, и молярных масс реагирующих веществ. Размерность титра – г/мл. Величина является постоянной для данного ЛВ, определяемого конкретным титруемым раствором.
Поправочный коэффициент титрованного раствора (К) – отношение реально полученной концентрации титрованного раствора к теоретически заданной.
|
Пример 1: В аналитический кабинет аптеки поступил Раствор кальция глюконата 3%. В ходе анализа было установлено, что на титрование 1 мл раствора израсходовалось 1,35 мл 0,05 моль/л раствора трилона Б. Какое фактическое содержание кальция глюконата в анализируемом растворе?
Химизм:
Са2+ + Na2H2ЭДТА → Са•Na2ЭДТА + 2 Н+
Решение: Определяемое вещество (Б) –кальция глюконат;
Титрованный раствор (титрант) (А) - 0,05 моль/л раствор трилона Б.
Титр 0,05 моль/л раствора трилона Б по кальция глюконату, рассчитываем по формуле (2):
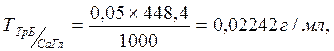 Принимая условно коэффициент титрованного раствора К равным 1, концентрация кальция глюконата в растворе, рассчитываемая по формуле (1) будет равна:
Принимая условно коэффициент титрованного раствора К равным 1, концентрация кальция глюконата в растворе, рассчитываемая по формуле (1) будет равна:
 Заключение: Фактическая концентрация кальция глюконата в растворе соответствует 3,03%.
Заключение: Фактическая концентрация кальция глюконата в растворе соответствует 3,03%.
|
Расчет содержания ЛВ в граммах, проводят также по формуле (1), но в числителе вместо цифры 100 подставляют величину общей массы (г) или общего объема (мл) ЛС.
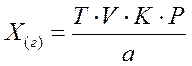 (3), (3),
где Х(г) – содержание ЛВ в ЛС в граммах;
Р – общий объем жидкого ЛС (мл) или общая масса твердого или мягкого ЛС (г).

| Существуют различные виды лекарственных форм (ЛФ):
К твердым ЛФ относят порошки (Pulveres), сборы (Species), твердые желатиновые капсулы (Capsulae durae), таблетки (Tabulettae), пилюли (Pilulae), гранулы (Granulae), драже (Dragee), карамели (Caramel) и пастилки, или троше (Trochisci);
К жидким ЛФ — растворы (Solutiones), суспензии (Suspensiones), эмульсии (Emulsa), настои (Inflisa), отвары (Decocta), настойки (Tincturae), жидкие экстракты (Extracta fluida), линименты (Unimenta), жидкие пластыри или кожные клеи (Emplastra), микстуры (Mixturae) и капли (Guttae), а также соки свежих растений;
К мягким ЛФ — мази (Unguenta), пасты (Pastae), суппозитории ректальные, или свечи (Suppositoria rectalia), суппозитории вагинальные (Suppositoria vaginalia), палочки (Bacilli), капсулы мягкие, или эластичные (Capsulae molles, Capsulae elasticae), твердые пластыри (Emplastra) и др..
|
Пример 2: Для больного Н был приготовлен по прописи порошок состава:
Кислоты аскорбиновой 0,1 г
Кальция глюконата 0,25 г
При количественном определении кальция глюконата в ЛФ на 0,05 г порошка израсходовалось 1,60 мл 0,05 моль/л раствора трилона Б. Соответствует ли содержание кальция глюконата в порошке?
Химизм:
Са2+ + Na2H2ЭДТА → Са•Na2ЭДТА + 2 Н+
Решение: Определяемое вещество (Б) – глюконат кальция;
Титрованный раствор (титрант) (А) - 0,05 моль/л раствор трилона Б.
Титр 0,05 моль/л раствора трилона Б по кальция глюконату, рассчитываем по формуле (2):
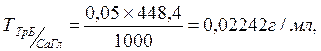 Общая масса порошка равна сумме входящих в его состав ингредиентов:
Р = 0,1 + 0,25 = 0,35 г
Принимая условно коэффициент титрованного раствора К равным 1, содержание кальция глюконата в растворе, рассчитываемое по формуле (3) будет равно:
Общая масса порошка равна сумме входящих в его состав ингредиентов:
Р = 0,1 + 0,25 = 0,35 г
Принимая условно коэффициент титрованного раствора К равным 1, содержание кальция глюконата в растворе, рассчитываемое по формуле (3) будет равно:
 Заключение о доброкачественности лекарственного средства дается на основании сопоставления результата анализа с допустимыми нормами отклонения по действующим НД. Чаще всего рассчитывают отклонение от прописной массы в процентах.
Находим разность между прописной массой и фактической массой кальция глюконата:
0,25 - 0,251 = 0,001 г
В процентном соотношении отклонение будет составлять:
0,25 г – 100%
0,001 г – х% →
Заключение о доброкачественности лекарственного средства дается на основании сопоставления результата анализа с допустимыми нормами отклонения по действующим НД. Чаще всего рассчитывают отклонение от прописной массы в процентах.
Находим разность между прописной массой и фактической массой кальция глюконата:
0,25 - 0,251 = 0,001 г
В процентном соотношении отклонение будет составлять:
0,25 г – 100%
0,001 г – х% → 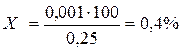 Для кальция глюконата отклонение в массе при прописной массе 0,25 г должно быть ± 8% (см.приложение). Рассчитанное отклонение составляет +0,4%.
Заключение: ЛС соответствует требованиям прописи по содержанию кальция глюконата.
Пример 3: Сделать заключение о качестве ЛФсостава:
Кофеина – натрия бензоата 0,5 г
Раствора натрия бромида 2% - 200,0 мл
по содержанию в ней натрия бромида, если при анализе 2,00 мл ЛФ израсходовалось 3,75 мл 0,1 моль/л раствора серебра нитрата.
Химизм:
NaBr + AgNO3 → AgBr↓ + NaNO3
Решение: Т = 0,01029 г/мл, общий объем ЛФ – Р = 200,0 мл. Принимая условно коэффициент титрованного раствора К равным 1, содержание натрия бромида равно:
Для кальция глюконата отклонение в массе при прописной массе 0,25 г должно быть ± 8% (см.приложение). Рассчитанное отклонение составляет +0,4%.
Заключение: ЛС соответствует требованиям прописи по содержанию кальция глюконата.
Пример 3: Сделать заключение о качестве ЛФсостава:
Кофеина – натрия бензоата 0,5 г
Раствора натрия бромида 2% - 200,0 мл
по содержанию в ней натрия бромида, если при анализе 2,00 мл ЛФ израсходовалось 3,75 мл 0,1 моль/л раствора серебра нитрата.
Химизм:
NaBr + AgNO3 → AgBr↓ + NaNO3
Решение: Т = 0,01029 г/мл, общий объем ЛФ – Р = 200,0 мл. Принимая условно коэффициент титрованного раствора К равным 1, содержание натрия бромида равно:
 В ЛС прописано натрия бромида 4 г (2х2), а найдено 3,86 г. Следовательно, отклонение составляет 4 – 3,86 = 0,14 г. В процентном соотношении отклонение будет составлять:
4 г – 100%
0,14 г – х% →
В ЛС прописано натрия бромида 4 г (2х2), а найдено 3,86 г. Следовательно, отклонение составляет 4 – 3,86 = 0,14 г. В процентном соотношении отклонение будет составлять:
4 г – 100%
0,14 г – х% →  Для натрия бромида отклонение в массе при прописной массе 0,25 г должно быть ± 5%. Рассчитанное отклонение составляет -3,5%.
Заключение: ЛС соответствует требованиям прописи по содержанию натрия бромида.
Для натрия бромида отклонение в массе при прописной массе 0,25 г должно быть ± 5%. Рассчитанное отклонение составляет -3,5%.
Заключение: ЛС соответствует требованиям прописи по содержанию натрия бромида.
|
В случае если на титрование ЛВ расходуется большой объем титрованного раствора, проводят разведение навески (объема) ЛС в мерной колбе с последующим отбором из нее пробы для выполнения анализа.
При разведении концентрация вещества (%) или его содержание в граммах будут вычисляться по формулам (1) и (3) с учетом поправки -  , где Vм.к – объем мерной колбы используемой для разведения (мл), Vа – объем разведенного раствора, взятого на анализ (мл). , где Vм.к – объем мерной колбы используемой для разведения (мл), Vа – объем разведенного раствора, взятого на анализ (мл).
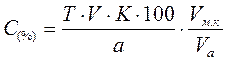 (4), (4),
 (5), (5),
Пример 4: Анализ концентрированного раствора кальция хлорида 10% проводился по методике: к 1,00 мл раствора прибавляли пипеткой точно 9,00 мл воды. К 2,00 мл полученного раствора прибавляли 5 мл воды, 5 мл аммиачного буферного раствора, 0,05 г индикаторной смеси кислотного хром-темно-синего и титровали 0,05 моль/л раствором трилона Б до сине-фиолетового окрашивания. В результате анализа было установлено, что на титрование расходуется 1,83 мл титрованного раствора. Каково фактическое содержание кальция хлорида в растворе?
Химизм:
Са2+ + Na2H2ЭДТА → Са•Na2ЭДТА + 2 Н+
Решение: Анализ проводился с разведением исходного раствора. Для разведения брали объем (а) – 1 мл, объем разведения составил - Vм.к. = 1,00 мл (раствора CaCl2) + 9,00 мл (воды)=10 мл; объем разведенного раствора, используемый для титрования - Vа = 2,00 мл; Т = 0,01029 г/мл.
Принимая условно коэффициент титрованного растворов К равным 1, концентрация кальция хлорида в растворе составила:
 Заключение: Концентрация кальция хлорида в растворе соответствует 10,02%
Заключение: Концентрация кальция хлорида в растворе соответствует 10,02%
|
|



 (1),
(1),
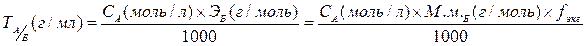 (2),
(2),
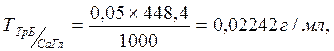 Принимая условно коэффициент титрованного раствора К равным 1, концентрация кальция глюконата в растворе, рассчитываемая по формуле (1) будет равна:
Принимая условно коэффициент титрованного раствора К равным 1, концентрация кальция глюконата в растворе, рассчитываемая по формуле (1) будет равна:
 Заключение: Фактическая концентрация кальция глюконата в растворе соответствует 3,03%.
Заключение: Фактическая концентрация кальция глюконата в растворе соответствует 3,03%.
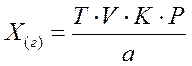 (3),
(3),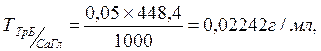 Общая масса порошка равна сумме входящих в его состав ингредиентов:
Р = 0,1 + 0,25 = 0,35 г
Принимая условно коэффициент титрованного раствора К равным 1, содержание кальция глюконата в растворе, рассчитываемое по формуле (3) будет равно:
Общая масса порошка равна сумме входящих в его состав ингредиентов:
Р = 0,1 + 0,25 = 0,35 г
Принимая условно коэффициент титрованного раствора К равным 1, содержание кальция глюконата в растворе, рассчитываемое по формуле (3) будет равно:
 Заключение о доброкачественности лекарственного средства дается на основании сопоставления результата анализа с допустимыми нормами отклонения по действующим НД. Чаще всего рассчитывают отклонение от прописной массы в процентах.
Находим разность между прописной массой и фактической массой кальция глюконата:
0,25 - 0,251 = 0,001 г
В процентном соотношении отклонение будет составлять:
0,25 г – 100%
0,001 г – х% →
Заключение о доброкачественности лекарственного средства дается на основании сопоставления результата анализа с допустимыми нормами отклонения по действующим НД. Чаще всего рассчитывают отклонение от прописной массы в процентах.
Находим разность между прописной массой и фактической массой кальция глюконата:
0,25 - 0,251 = 0,001 г
В процентном соотношении отклонение будет составлять:
0,25 г – 100%
0,001 г – х% → 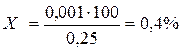 Для кальция глюконата отклонение в массе при прописной массе 0,25 г должно быть ± 8% (см.приложение). Рассчитанное отклонение составляет +0,4%.
Заключение: ЛС соответствует требованиям прописи по содержанию кальция глюконата.
Пример 3: Сделать заключение о качестве ЛФсостава:
Кофеина – натрия бензоата 0,5 г
Раствора натрия бромида 2% - 200,0 мл
по содержанию в ней натрия бромида, если при анализе 2,00 мл ЛФ израсходовалось 3,75 мл 0,1 моль/л раствора серебра нитрата.
Химизм:
NaBr + AgNO3 → AgBr↓ + NaNO3
Решение: Т = 0,01029 г/мл, общий объем ЛФ – Р = 200,0 мл. Принимая условно коэффициент титрованного раствора К равным 1, содержание натрия бромида равно:
Для кальция глюконата отклонение в массе при прописной массе 0,25 г должно быть ± 8% (см.приложение). Рассчитанное отклонение составляет +0,4%.
Заключение: ЛС соответствует требованиям прописи по содержанию кальция глюконата.
Пример 3: Сделать заключение о качестве ЛФсостава:
Кофеина – натрия бензоата 0,5 г
Раствора натрия бромида 2% - 200,0 мл
по содержанию в ней натрия бромида, если при анализе 2,00 мл ЛФ израсходовалось 3,75 мл 0,1 моль/л раствора серебра нитрата.
Химизм:
NaBr + AgNO3 → AgBr↓ + NaNO3
Решение: Т = 0,01029 г/мл, общий объем ЛФ – Р = 200,0 мл. Принимая условно коэффициент титрованного раствора К равным 1, содержание натрия бромида равно:
 В ЛС прописано натрия бромида 4 г (2х2), а найдено 3,86 г. Следовательно, отклонение составляет 4 – 3,86 = 0,14 г. В процентном соотношении отклонение будет составлять:
4 г – 100%
0,14 г – х% →
В ЛС прописано натрия бромида 4 г (2х2), а найдено 3,86 г. Следовательно, отклонение составляет 4 – 3,86 = 0,14 г. В процентном соотношении отклонение будет составлять:
4 г – 100%
0,14 г – х% →  Для натрия бромида отклонение в массе при прописной массе 0,25 г должно быть ± 5%. Рассчитанное отклонение составляет -3,5%.
Заключение: ЛС соответствует требованиям прописи по содержанию натрия бромида.
Для натрия бромида отклонение в массе при прописной массе 0,25 г должно быть ± 5%. Рассчитанное отклонение составляет -3,5%.
Заключение: ЛС соответствует требованиям прописи по содержанию натрия бромида.
 , где Vм.к – объем мерной колбы используемой для разведения (мл), Vа – объем разведенного раствора, взятого на анализ (мл).
, где Vм.к – объем мерной колбы используемой для разведения (мл), Vа – объем разведенного раствора, взятого на анализ (мл).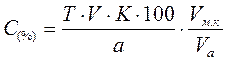 (4),
(4), (5),
(5), Заключение: Концентрация кальция хлорида в растворе соответствует 10,02%
Заключение: Концентрация кальция хлорида в растворе соответствует 10,02%



