
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчеты при титровании лекарственных средств, состоящих из близких по свойствам лекарственных вещест.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В ряде ЛС химическая структура ингредиентов не позволяет подобрать селективные методы для количественного определения каждого из них в отдельности: мешающие друг другу ингредиенты взаимодействуют с одними и теми же титрантами (например, галогениды гетероциклических азотистых оснований при совместном присутствии в ЛС). В этих случаях проводят суммарное титрование ЛВ наиболее простым и доступным методом, а затем подбирают методы, позволяющие провести раздельное титрование хотя бы некоторых из этих ингредиентов. В формулах расчета содержания суммарно титруемых ЛВ учитывается: разность объемов титрованных растворов, затраченных на суммарное и раздельное титрование ЛВ, массы используемых навесок, факторы эквивалентности определяемых веществ, концентрации титрованных растворов. В связи с этим, содержание ЛВ, титруемых отдельно, рассчитывают как было описано в п.п. 1.1. – 1.3. Содержание ЛВ, которое невозможно определить селективно, рассчитывают по формуле.
где V1 и V2 – соответственно объемы титрованных растворов, израсходованные на раздельное титрование одного из ЛВ и суммарное титрование обоих ЛВ, К1 и К2 – поправочные коэффициенты соответствующих титрованных растворов. Применение формулы (9) для расчетов содержания ЛВ при суммарном титровании возможно лишь в том случае, если суммарное и раздельное титрование ингредиентов проводится титрованными растворами равной концентрации, в одной и той же навеске (или равной навеске) и одинаковой молярной массе эквивалента одного из ингредиентов в используемых методах: В зависимости от изменения условий суммарного и раздельного титрования основная формула расчета (9) будет претерпевать преобразования. а) Если суммарное и раздельное титрование ЛВ проводится титрованным растворам разной концентрации, то необходимо провести перерасчет, для приведения титрованных растворов к одной концентрации.
где С1 и С2 – соответственно концентрация используемых титрованных растворов.
б) Если суммарное и раздельное титрование ЛВ проводится в разных навесках (анализируемых объемах ЛС), при равенстве концентрации титрованных растворов и величины эквивалентов, то содержание второго ЛВ рассчитывают по формуле с приведением навески к одной величине:
где а1 и а2 – соответственно массы навесок (анализируемых объемов ЛФ), взятых для раздельного и суммарного титрования ингредиентов анализируемой формы (в г (мл)).
в) В случае проведения суммарного и раздельного титрование ЛВ в навесках разной величины и титрованными растворами разной концентрации проводиться перерасчет для приведения массы навесок (анализируемых объемов ЛФ) и концентраций к равным величинам:
г) Для суммарного и раздельного титрования ЛВ часто используются методики в которых величины эквивалента одного из ЛВ различны, в таких случаях их приводят к одному значению эквивалента, используя в расчетах факторы эквивалентности ЛВ в реакциях титрования. Основная формула нахождения второго ЛВ будет выглядеть следующим образом:
где f1 и f2 – соответственно факторы эквивалентности ЛВ, которое участвует как в раздельном, так и в суммарном титровании. д) Существуют методики количественного определения ЛВ в многокомпонентных ЛС, в которых титрование проводиться в разных навесках (объемах) различными титрованными растворами и величины эквивалентов ЛВ в титриметрических методах – различны, тогда в формуле необходимо ввести перерасчет на все различные величины:
|
|||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 2679; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.10.139 (0.007 с.) |

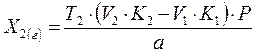 (9),
(9), (9а),
(9а),

 Решение: Исходя из условий титрования а1 = а2 =1,00 мл, молярные массы эквивалентов димедрола в аргентометрическом и алкалиметрическом титровании равны, отличаются лишь концентрации титрованных растворов серебра нитрата и гидроксида натрия С1 =0,01 моль/л, С2 =0,1 моль/л.
Содержание димедрола в ЛС находиться по формуле (3).
Т1 =0,00292 г/мл, Р =10 мл, тогда:
Решение: Исходя из условий титрования а1 = а2 =1,00 мл, молярные массы эквивалентов димедрола в аргентометрическом и алкалиметрическом титровании равны, отличаются лишь концентрации титрованных растворов серебра нитрата и гидроксида натрия С1 =0,01 моль/л, С2 =0,1 моль/л.
Содержание димедрола в ЛС находиться по формуле (3).
Т1 =0,00292 г/мл, Р =10 мл, тогда:
 Содержание кислоты борной, исходя из условий титрования, будет рассчитываться по формуле с приведением концентраций к общему значению:
Титр титрованного раствора 0,1 моль/л гидроксида натрия по определяемому веществу – кислоте борной будет равен: Т2 =0,00618 г/мл.
Общий объем ЛФ Р = 10 мл., тогда используя формулу (9а) получаем:
Содержание кислоты борной, исходя из условий титрования, будет рассчитываться по формуле с приведением концентраций к общему значению:
Титр титрованного раствора 0,1 моль/л гидроксида натрия по определяемому веществу – кислоте борной будет равен: Т2 =0,00618 г/мл.
Общий объем ЛФ Р = 10 мл., тогда используя формулу (9а) получаем:
 Заключение: С одержанию димедрола в ЛС – 0,021 г; содержание борной кислоты – 0,2 г.
Заключение: С одержанию димедрола в ЛС – 0,021 г; содержание борной кислоты – 0,2 г.
 (9б),
(9б), Решение: Исходя из условий титрования концентрации титрованных растворов равны, величины эквивалентов новокаина в алкалиметрическом и аргентометрическом методах титрования равны. Для анализа используются лишь различные по величине объемы ЛФ. а1 = 1,00 мл, а2 =0,50 мл. Исходя из этого, содержание калия иодида будет находиться по формуле:
Решение: Исходя из условий титрования концентрации титрованных растворов равны, величины эквивалентов новокаина в алкалиметрическом и аргентометрическом методах титрования равны. Для анализа используются лишь различные по величине объемы ЛФ. а1 = 1,00 мл, а2 =0,50 мл. Исходя из этого, содержание калия иодида будет находиться по формуле:

 (9в),
(9в), (9г),
(9г), (9д),
(9д), Суммарное титрование:
Суммарное титрование:

 Решение: Количественное определение кислот никотиновой (КН) и аскорбиновой (КА) проводят в одной колбе. Сначала определяется сумма кислот титрованием 0,1 моль/л раствором натрия гидроксида. Факторы эквивалентности кислоты никотиновой (f) и кислоты аскорбиновой (f1) в методе нейтрализации равны 1.
Далее для определения кислоты аскорбиновой полученный аскорбат натрия титруют 0,05 моль/л раствором йода. Фактор эквивалентности кислоты аскорбиновой (f2) в методе йодометрии – 1/2.
Титры соответствующих титрованных растворов по кислоте аскорбиновой (Т1) и кислоте никотиновой (Т2) равны:
Решение: Количественное определение кислот никотиновой (КН) и аскорбиновой (КА) проводят в одной колбе. Сначала определяется сумма кислот титрованием 0,1 моль/л раствором натрия гидроксида. Факторы эквивалентности кислоты никотиновой (f) и кислоты аскорбиновой (f1) в методе нейтрализации равны 1.
Далее для определения кислоты аскорбиновой полученный аскорбат натрия титруют 0,05 моль/л раствором йода. Фактор эквивалентности кислоты аскорбиновой (f2) в методе йодометрии – 1/2.
Титры соответствующих титрованных растворов по кислоте аскорбиновой (Т1) и кислоте никотиновой (Т2) равны:

 Р = 0,1 (КА) + 0,1 (КН) + 0,5 (Сахар) = 0,7 г
Содержание кислоты аскорбиновой (ХКА, г) рассчитываем по формуле прямого титрования (см формулу (3)):
Р = 0,1 (КА) + 0,1 (КН) + 0,5 (Сахар) = 0,7 г
Содержание кислоты аскорбиновой (ХКА, г) рассчитываем по формуле прямого титрования (см формулу (3)):
 Учитывая, что а1 = 0,05г; а2 =0,10 г; С1 =0,05 моль/л, С2 =0,1 моль/л., f1 = 1, а f2 = ½, то для нахождения содержания кислоты никотиновой (Х КН, г) в ЛФ нам необходимо использовать формулу (9д):
Учитывая, что а1 = 0,05г; а2 =0,10 г; С1 =0,05 моль/л, С2 =0,1 моль/л., f1 = 1, а f2 = ½, то для нахождения содержания кислоты никотиновой (Х КН, г) в ЛФ нам необходимо использовать формулу (9д):
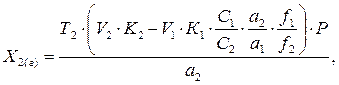
 Заключение: С одержание кислоты аскорбиновой в ЛС – 0,1 г; содержание кислоты никотиновой – 0,097 г.
Заключение: С одержание кислоты аскорбиновой в ЛС – 0,1 г; содержание кислоты никотиновой – 0,097 г.



