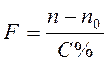Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Продолжительность занятия: 225 мин (1 занятие)Содержание книги
Поиск на нашем сайте
Цель занятия: - приобрести практический навык использования методов титриметрии и рефрактометрии для анализа концентрированных растворов.
Задачи: - закрепление навыков использования химических и физико-химических методов для анализа концентрированных растворов; - закрепление техники выполнения и проведения расчетов при использовании титриметрии и рефрактометрии; Задание на занятие: Студент получая задание – анализ одного или нескольких концентрированных растворов должен: - определить фактор показателя преломления раствора препарата; - провести реакции подлинности по входящим ЛВ; - определить концентрации вещества в растворе методом титриметрии и рефрактометрии; - рассчитать содержание ЛВ с использованием формул расчета; - используя формулы расчета для исправления концентрации растворов, изготовленных массо-объемным способом, рассчитать количество воды (вещества), необходимого для приведения концентрации к норме; - оформить отчетную документацию по форме журналов. Концентрированные растворы – это рабочие растворы лекарственных веществ определенной, более высокой концентрации, чем эти растворы прописываются в рецептах. Применение концентрированных растворов облегчает работу фармацевта, увеличивает производительность труда, способствует повышению качества приготовленных жидких лекарственных форм и ускоряет их отпуск населению. Номенклатура концентрированных растворов определяется спецификой экстемпоральной рецептуры и объемом работы аптек. Примерный перечень концентрированных растворов и их сроки годности приведены в инструкциях по контролю качества лекарств. Концентрированные растворы хранят в соответствии с физико-химическими свойствами веществ, входящих в их состав, в хорошо закрывающихся штангласах, в защищенном от солнечных лучей месте, при температуре не выше 25 °С или в холодильнике при температуре 3 - 50С. На штанглас прикрепляют этикетку с указанием названия и концентрации раствора, номера серии, даты приготовления и номера анализа. Приготавливают растворы по мере надобности с учетом объема работы и срока их годности. Изменение цвета, помутнение, появление хлопьев, налета являются признаками непригодности растворов.
Концентрированные растворы приготавливают в асептических условиях на свежеперегнанной воде, используя мерную посуду (мерные колбы, цилиндры). При приготовлении концентрированных растворов следует избегать концентраций, близких к насыщенным, так как при понижении температуры раствора возможна кристаллизация растворенного вещества. Приготовленные растворы фильтруют и подвергают полному химическому анализу (подлинность, чистота, количественное содержание вещества).
При исправлении концентрации растворов, приготовленных массо-объемным способом, используют формулы: а) Концентрация раствора оказалась выше требуемой. Объем воды, необходимый для разбавления полученного раствора равен:
где Х – количество воды, необходимое для разбавления изготовленного раствора (мл.); Р – объем изготовленного раствора (мл.); С – требуемая концентрация раствора (%); Спракт – фактическая концентрация раствора (%).
б) Концентрация раствора оказалась ниже требуемой. Массу ЛВ для укрепления полученного раствора вычисляют по формуле:
где Х – масса ЛВ, которую следует добавить к раствору (г); Р – объем изготовленного раствора (мл.); С – требуемая концентрация раствора (%); Спракт – фактическая концентрация раствора (%); ρ20 - плотность раствора при 200С (г/мл, г/см3).
Самостоятельная работа студента на занятии Задание №1. Измерить показатели преломления растворов вещества (по указанию преподавателя) 4-5 точных концентраций. Для каждой концентрации рассчитать значение фактора показателя преломления по формуле:
Результаты измерений занести в таблицу и рассчитать среднее значение:
Растворы для определения фактора показателя преломления: 1. Борная кислота 3, 4, 5, 6 % 2. Натрия йодид 5, 10, 15, 20 % 3. Натрия гидрокарбонат 3, 4, 5, 6 % 4. Натрия салицилат 2, 3, 4, 5 % 5. Сульфацил-натрий 10, 15, 20, 30%
Задание №2. Провести анализ концентрированных растворов (по указанию преподавателя) титриметрическим и рефрактометрическим методом. Рассчитать Н.О., количество веществ для укрепления (разведения) растворов, если это необходимо. Сделать заключение о качестве изготовленного раствора.
Пропись 1. Раствор кальция глюконата 5% Определение подлинности 1. К 0,5 – 1 мл раствора прибавляют 3 - 5 капель раствора оксалата аммония. Образуется белый осадок, нерастворимый в разведенной уксусной кислоте и растворе аммиака, растворимый в разведенных минеральных кислотах. 2. К 0,5 – 2 мл раствора прибавляют 1 – 2 капли раствора хлорида окисного железа. Появляется светло-зеленое окрашивание. 3. 4 – 5 капель раствора помещают в фарфоровую чашку и выпаривают при нагревании на водяной бане. К сухому остатку прибавляют несколько кристаллов β-нафтола, 5 – 6 капель концентрированной серной кислоты и осторожно нагревают на водяной бане 1 мин. Появляется сине-зеленое окрашивание. Количественное определение 1. К 0,5 мл раствора прибавляют 5 мл аммиачного буферного раствора, 0,05 г индикаторной смеси кислотного хром темно-синего и титруют 0,05 моль/л раствором трилона Б до фиолетового окрашивания. Параллельно проводят контрольный опыт. 2. Концентрацию определяют рефрактометрическим методом, используя формулу и рефрактометрические таблицы.
Пропись 2. Раствор калия бромида 20% Определение подлинности 1. К 4 – 5 каплям раствора прибавляют 4 - 5 капель воды, по 2 – 3 капли разведенной уксусной кислоты и раствора кобальтнитрита натрия. Образуется желтый кристаллический осадок. 2. К 2 – 3 каплям раствора прибавляют 1 мл воды, 2 – 3 капли разведенной хлористоводородной кислоты, 3 – 5 капель раствора хлорамина, 1 мл хлороформа и взбалтывают. Хлороформный слой окрашивается в желто-бурый цвет.
Количественное определение 1. 2 мл раствора разбавляют в мерной колбе до 100 мл. К 10 мл раствора прибавляют 5 капель раствора калия хромата и титруют 0,1 моль/л раствором серебра нитрата до буровато-желтого окрашивания. 2. Концентрацию определяют рефрактометрическим методом, используя формулу и рефрактометрические таблицы.
Пропись 3. Раствор натрия бензоата 10% Определение подлинности К 2 – 3 каплям раствора прибавляют 0,5 - 1 мл воды и 1 – 2 капли раствора окисного железа хлорида. Образуется розовато-желтый осадок. Количественное определение 1. 10 мл раствора разбавляют в мерной колбе до 100 мл. К 10 мл раствора прибавляют 10 мл эфира, 1 каплю метилового оранжевого и титруют 0,1 моль/л раствором хлористоводородной кислоты при сильном встряхивании до розового окрашивания водного слоя. 2. Концентрацию определяют рефрактометрическим методом, используя формулу и рефрактометрические таблицы.
Пропись 4. Раствор магния сульфата 20% Определение подлинности 1. К 2 – 3 каплям раствора прибавляют 0,5 – 1 мл воды, по 1 мл растворов аммония хлорида и аммиака и 0,5 мл раствора натрия фосфата. Образуется белый кристаллический осадок, растворимый в разведенных минеральных и уксусной кислотах. 2. К 2 – 3 каплям раствора прибавляют 3 – 5 капель воды и 2 – 3 капли раствора хлорида бария. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах. Количественное определение 1. 10 мл раствора разбавляют в мерной колбе до 100 мл. К 2 мл раствора прибавляют 5 мл аммиачного буферного раствора, 0,1 г индикаторной смеси кислотного хром-черного специального и титруют 0,05 моль/л раствором трилона Б до синего окрашивания. Параллельно проводят контрольный опыт. 2. Концентрацию определяют рефрактометрическим методом, используя формулу и рефрактометрические таблицы.
Пропись 5. Раствор аммония хлорида 10% Определение подлинности 1. 2 – 3 капли раствора нагревают с 0,5 мл раствора натрия гидроксида; выделяется аммиак, обнаруживаемый по запаху и по посинению влажной красной лакмусовой бумаги. 2. К 2 – 3 каплям раствора прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора серебра нитрата; образуется белый творожистый осадок, нерастворимый в разведенной азотной кислоте и растворимый в растворе аммиака Количественное определение. 1. 5 мл раствора разбавляют в мерной колбе водой до 100 мл. К 5 мл разведения прибавляют 5 капель раствора калия хромата и титруют 0,1 моль/л раствором серебра нитрата до буровато-желтого окрашивания.
2. Концентрацию определяют рефрактометрическим методом, используя формулу и рефрактометрические таблицы.
Пропись 6. Раствор кофеина-бензоата натрия 10% Определение подлинности 1. 3-4 капли раствора выпаривают на водяной бане. К сухому остатку прибавляют по 10 капель разведенной хлористоводородной кислоты и пергидроля, выпаривают на водяной бане. После охлаждения к сухому остатку добавляют 3-5 капель раствора аммиака. Появляется пурпурно-красное окрашивание. 2. К 3 – 4 каплям раствора прибавляют 1 – 2 мл воды и 2 – 3 капли раствора железа окисного хлорида. Образуется розовато-желтый осадок. Количественное определение 1. 2 мл раствора разбавляют в мерной колбе до 100 мл. К 2 мл раствора прибавляют 10 мл воды, 10 мл эфира, 1 каплю раствора метилового оранжевого и титруют 0,1 моль/л раствором хлористоводородной кислоты при сильном встряхивании до розового окрашивания водного слоя. 2. Концентрацию определяют рефрактометрическим методом, используя формулу и рефрактометрические таблицы.
Контрольные вопросы и задачи. 1. Укажите отличия качественного и количественного экспресс-анализа ЛС в условиях аптеки от фармакопейного анализа. 2. В чем сущность метода рефрактометрии? 3. Что такое показатель преломления? Принцип аддитивности показателя преломления. Как он используется в количественном определении. 4. Факторы, влияющие на изменение показателя преломления. 5. Зависимость показателя преломления от температуры. Методика определения показателя преломления. 6. Фактор показателя преломления. Приведите примеры ЛВ с постоянным фактором показателя преломления. 7. Какие растворы называются концентрированными? С какой целью их используют в аптеках? 8. Опишите алгоритм внутриаптечного контроля Раствора магния сульфата 50%. 9. Как проводиться контроль прозрачности и степени мутности растворов. 10. Приведите формулы и латинские названия кальция глюконата, калия бромида, натрия бензоата, магния сульфата, аммония хлорида и кофеин-бензоата натрия. 11. Приведите реакции определения подлинности указанных веществ. 12. Какими методами можно определить вышеуказанные соединения в условиях аптеки и в контрольно-аналитической лаборатории? Приведите формулы расчета. 13. Решить задачи: 13.1. На анализ поступили растворы аммония хлорида 9,8%, и 11% (стандартный раствор 10% - 1 л). Рассчитать отклонения, допускаемые в концентрате, количество воды, необходимое для разбавления раствора, количество аммония хлорида, которое необходимо добавить для укрепления раствора (ρ=1,0291 г/см3). 13.2. На анализ поступили растворы гексаметилентетрамина 41%, и 37% (стандартный раствор 40% - 1 л). Рассчитать отклонения, допускаемые в концентрате, количество воды, необходимое для разбавления раствора, количество гексаметилентетрамина, которое необходимо добавить для укрепления раствора (ρ=1,0880 г/см3). 13.3. На анализ поступили растворы глюкозы 47%, и 52% (стандартный раствор 50% - 1 л). Рассчитать отклонения, допускаемые в концентрате, количество воды, необходимое для разбавления раствора, количество глюкозы, которое необходимо добавить для укрепления раствора (ρ=1,1857г/см3).
13.4. Рассчитайте концентрацию раствора кальция хлорида, пользуясь рефрактометрической таблицей, если показатель преломления раствора равен 1,3453. 13.5. Пользуясь рефрактометрическими таблицами, определите концентрацию раствора гексаметилентетрамина, если показатель преломления раствора 1,3452. 13.6. При температуре 25 0С показатель преломления раствора равен 1,3372, фактор показателя преломления 0,0016. Рассчитайте концентрацию раствора.
Занятие № 2
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 1356; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.7.190 (0.008 с.) |

 ,
, ,
, т.е. к 1 л 23% раствора калия бромида следует добавить 150 мл воды очищенной для получения 20% раствора.
Ответ: необходимо добавить 150 мл воды.
Пример 22: При анализе установлено, что концентрация раствора калия бромида составляет 18% вместо 20%. Рассчитать количество калия бромида, необходимое для укрепления раствора. Объем приготовленного концентрированного раствора – 1 л.
Решение:
т.е. к 1 л 23% раствора калия бромида следует добавить 150 мл воды очищенной для получения 20% раствора.
Ответ: необходимо добавить 150 мл воды.
Пример 22: При анализе установлено, что концентрация раствора калия бромида составляет 18% вместо 20%. Рассчитать количество калия бромида, необходимое для укрепления раствора. Объем приготовленного концентрированного раствора – 1 л.
Решение:
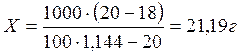 т.е. для укрепления раствора к 1л 18% раствора следует добавить 21,19 г калия бромида для получения 20% раствора.
Ответ: необходимо добавить 21,19 г калия бромида.
Пример 23: На анализ поступили растворы глюкозы 41%, и 38% (стандартный раствор 40% - 1 л), рассчитать отклонения, допускаемые в концентрате, количество воды, необходимое для разбавления раствора, количество глюкозы, которое необходимо добавить для укрепления раствора.
Решение:
Раствор глюкозы 40%, следовательно, норма отклонения ± 1%
40% - 100%
Х % - 1% →
т.е. для укрепления раствора к 1л 18% раствора следует добавить 21,19 г калия бромида для получения 20% раствора.
Ответ: необходимо добавить 21,19 г калия бромида.
Пример 23: На анализ поступили растворы глюкозы 41%, и 38% (стандартный раствор 40% - 1 л), рассчитать отклонения, допускаемые в концентрате, количество воды, необходимое для разбавления раствора, количество глюкозы, которое необходимо добавить для укрепления раствора.
Решение:
Раствор глюкозы 40%, следовательно, норма отклонения ± 1%
40% - 100%
Х % - 1% → 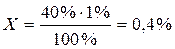 Допустимое отклонение в концентрации составляет 39,6% ÷ 40,4%.
1) Количество воды, необходимое для разбавления 41% раствора равно:
Допустимое отклонение в концентрации составляет 39,6% ÷ 40,4%.
1) Количество воды, необходимое для разбавления 41% раствора равно:
 2) Количество глюкозы, которое необходимо добавить для укрепления 38% раствора равно:
2) Количество глюкозы, которое необходимо добавить для укрепления 38% раствора равно:
 Ответ: Отклонение в концентрации составляет 39,6% ÷ 40,4%; количество воды для разбавления 41% раствора– 25 мл; количество глюкозы для укрепления 38% раствора – 26,7 г.
Ответ: Отклонение в концентрации составляет 39,6% ÷ 40,4%; количество воды для разбавления 41% раствора– 25 мл; количество глюкозы для укрепления 38% раствора – 26,7 г.