
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Эквивалент. Закон эквивалентовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Эквивалент (Э) – это реальная ли условная частица вещества, которая может присоединять, замещать, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. При определении эквивалента вещества необходимо исходить из конкретной реакции. Например: Из уравнения реакции кислотно-основного характера Следует, что одному иону водорода соответствует одна молекула Из окислительно-восстановительной реакции 2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O 2|MnO4- + 8H+ + 5 5| SO32- + H2O + 2 Следует, что одному электрону соответствует 1/5 молекула KMnO4 и ½ молекула Na2SO3, поэтому Э(окислителя) = 1/5, Э(восстановителя) = ½. Аналогично, эквивалент в реакциях обмена и замещения равен моль веществу, деленный на количество замещенных частиц. Таким образом, эквивалент вещества не является постоянной величиной, она зависит от реакции, в которой участвует данное вещество. Моль эквивалентов – количество вещества, содержащего 6,022×1023 эквивалентов. Масса одного моля эквивалентов вещества (элемента) называют молярной массой эквивалентов вещества ( Например:
Число, обозначающее какая доля от реальной частицы эквивалентно одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях, называют фактором эквивалентности (fэ). Например: Врассмотренных примерах: fэ( Закон эквивалентов (И.В. Рихтер, 1809 г) Химические элементы или вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
где Если одно из веществ или оба вещества, вступивших или получившихся в результате реакции, находится в газообразном состоянии, закон эквивалентов принимает вид:
где
Молярный объем эквивалента вещества ( Поскольку 1 моль любого газа при нормальных условиях занимает объем 22,4 л, то молярный объем эквивалента газообразного водорода будет равняться 11,2 л/моль, а кислорода – 5,6 л/моль. Молярная масса эквивалентов элемента в соединении не является величиной постоянной. Она зависит от валентности элемента в данном соединении и выражается уравнением:
где Молярные массы эквивалентов сложных веществ рассчитываются по следующим формулам:
1.2. Контрольные вопросы и задания 1. Что называется химическим эквивалентом? 2. Сформулируйте закон эквивалентов. 3. Как вычисляют эквиваленты элементов, оксидов, оснований, кислот, солей? Приведите примеры. 4. Определите эквивалент серы в соединениях: H2S, SO2, H2SO3, H2SO4. 5. Что такое моль эквивалентов и молярная масса эквивалентов? 6. Вычислите молярные массы эквивалента следующих веществ в реакциях обмена: KOH, H2S, H2SO4, Ca(OH)2, NH4OH, CuSO4. Составьте уравнения реакций. 7. Определите эквивалент двухвалентного металла, если 0,0977 г этого металла вытесняет 28 мл водорода при н.у. 8. При взаимодействии 0,5 г кальция с водородом образовалось 0,525 г гидрида кальция. Вычислите молярную массу эквивалента кальция и его эквивалент. 9. Вычислите молярную массу эквивалента металла, зная, что его хлорид содержит 79,78% хлора. Молярная масса эквивалента хлора равна 35,5 г/моль. 10. 0,304 г. Магния вытеснили 0,28 л водорода из соляной кислоты. Вычислите эквивалент магния и молярную массу его эквивалента.
1.3. Примеры решения задач Пример 1. Распределите соединения по классам и определите характер, назовите их:
Решение. Представим результаты в виде таблицы (13). Таблица 13
Пример 2. Докажите химический характер Решение.
Пример 3. Осуществите превращение: напишите уравнения реакций, укажите условия протекания процесса, дайте названия соединениям:
Решение.
Пример 4. Рассчитайте молярную массу эквивалентов серы в соединениях Решение Расчет ведем по формуле (8): а) SO2 – оксид серы, валентность серы в данном соединении равна 4 МЭ(S) = 32/ 4 = 8 г/моль б) H2SO4 – серная кислота, валентность серы в данном соединении равна 6 МЭ(S) = 32/ 6 = 5,33 г/моль в) H2S – сероводород, валентность серы в данном соединении равна 2 МЭ(S) = 32/ 2 = 16 г/моль Пример 5. Рассчитайте молярные массы эквивалентов (Мэ) следующих веществ Решение. Так как в молекуле
Так как в кислоте два атома водорода, то в случае замещения одного n = 1,
Пример 6. При сгорании металла образуется 9,43 г его оксида. Молярная масса эквивалента оксида металла равно 17 г/моль. Какая масса металла вступала в реакцию? Решение. Учитывая, что Пример 7. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите молярную массу эквивалентов оксида и молярную массу эквивалентов металла. Решение. Молярная масса водорода равная 2 г/моль при н.у. занимает объем 22,4 л, то объем молярной массы эквивалентов водорода (1 г/моль) будет равен 22,4: 2 = 11,2 л По закону эквивалентов формула (5):
Согласно закону эквивалентов Пример 8. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 мл кислорода (н.у.)? Решение. Молярная масса кислорода равная 32 г/моль при н.у. занимает объем 22,4 дм3, то объем молярной массы эквивалентов кислорода (8 г/моль) будет равен 22,4: 4 = 5,6 л = 5600 мл. По закону эквивалентов формула (7): Отсюда Пример 9. Из 3,85 г нитрата металла получено 1,6 г его гидроксида. Вычислите молярную массу эквивалентов металла. Решение. Молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
Молярная масса эквивалентов иона (катиона, аниона) равна отношению молярной массе иона к величине заряда иона.
Пример 10. Определить при н.у. объем азота собранного над водой при 20 0С и Р = 100 кПа. Рводяного пара = 2,3 кПа, Объем азота равен 120 см3. Решение. Разота = Р – Рводяного пара = 100 – 2,3 = 97,7 кПа. По формуле (4) объем азота равен: 1.4. Индивидуальные задания Задание 1. Используя характерные признаки, определите, к какому классу неорганических соединений относятся данные вещества и назовите их (используя приложение 2) (табл.14) Таблица 14 Варианты контрольного задания
Задание 2. Определитехимический характер оксидов и гидроксидов, подтвердив ответ реакциями (табл. 15). Таблица 15 Варианты контрольного задания
Задание 3. Осуществите превращения: напишите соответствующие уравнения реакций, укажите условия осуществления процесса, дайте название соединениям (табл. 16). Таблица16 Варианты контрольного задания
Продолжение табл.16
Задание 4. Рассчитайте молярную массу эквивалентов элемента (Мэ) в соединениях (табл. 17). Таблица 17 Варианты контрольного задания
Задание 5. Рассчитайте молярные массы эквивалентов (Мэ) следующих веществ, при условии, что в кислоте замещаются все атомы водорода, а у основания замещаются все группы ( Таблица 18 Варианты контрольного задания
Продолжение табл. 18
Задание 6. Решите задачи своего варианта (табл. 19). Таблица19 Варианты контрольного задания
Продолжение табл. 19
Окончание табл. 19
1.5. Тестовые задания
1. Амфотерными свойствами обладают оба оксида: а б 2. Кислотными свойствами обладают оба оксида: а б 3. Кислой солью является вещество: а б 4. Основанием является вещество: а б 5. В схеме превращений а б 6. Краткое ионное уравнение а б 7. В реакции, выраженной кратким ионным уравнением а б 8. Установите соответствие между названием оксида и группой, к которой он принадлежит.
9. Установите соответствие между формулой вещества и классом (или группой), к которому(ой) оно принадлежит.
10. Установите соответствие между исходными веществами и продуктами реакций.
11. Для расчета фактора эквивалентности вещества Н2СО3 используют число: а) замещаемых ионов водорода; б) отдаваемых электронов; в) принимаемых электронов; г) равное валентности углерода. 12. При нормальных условиях масса водорода, занимающего объем 44,8 дм3 равна (в г): а) 1 б) 2 в) 4 г) 8 13. Количество молекул, содержащихся в 10 моль углекислого газа, составляет: а) 1,204 · 1023 в) 12,04 · 1024 б) 6,023 · 1023 г) 6,023 · 1024 14. Молярная масса эквивалентов азотной кислоты равна величине (г/моль): а) 63 б) 31,5 в) 126 г) 189 15. Молярная масса эквивалентов гидроксида кальция равна величине (г/моль): а) 74 б) 37 в) 111 г) 18,5 16. Молярная масса эквивалентов карбоната кальция равна величине (г/моль): а) 50 б) 100 в) 25 г) 200 17. Единица измерения молярной массы эквивалента: а) г/моль в)безмерная величина б) моль/г г) г/дм3 18. При расчете М(1/zСu(OH)2) величина z в реакции а) 1 б)2 в)3 г) 4 19. При расчете М(1/z Н3РО4) величина z в реакции а) 1 б) 2 в) 3 г) 4 20. Название наименьшей частицы химического элемента, сохраняющей все его химические свойства: а) протон в) электрон б) атом г) ион
ТЕМА 2. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ (СОСТАВА) РАСТВОРА. Теоретические сведения Раствор – гомогенная термодинамически устойчивая система, состоящая из растворенного вещества, растворителя и продуктов их взаимодествия. Компонент, агрегатное состояние которого не изменяется при образовании раствора, называется растворителем, а другой компонент – растворенным веществом. При одинаковом агрегатно
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 2182; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.250.255 (0.011 с.) |

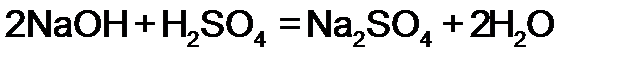 .
. и одна
и одна  ,
, 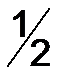 молекулы
молекулы  и
и 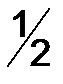 молекулы
молекулы  , поэтому Э(
, поэтому Э( → Mn2+ + 4H2O - окислитель, реакция восстановления
→ Mn2+ + 4H2O - окислитель, реакция восстановления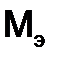 ), г/моль.
), г/моль. ;
;
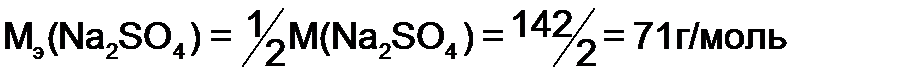
 (6)
(6) и
и  - массы веществ, г.,
- массы веществ, г.,  и
и 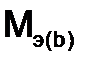 - молярные массы эквивалентов веществ, г/моль,
- молярные массы эквивалентов веществ, г/моль, 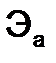 и
и 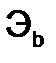 - эквиваленты веществ, моль.
- эквиваленты веществ, моль.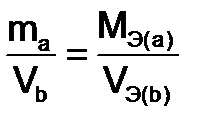 или
или 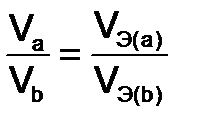 (7)
(7)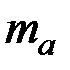 - масса твердого или жидкого вещества, г.,
- масса твердого или жидкого вещества, г.,  - молярная масса эквивалента твердого (жидкого) вещества, г/моль,
- молярная масса эквивалента твердого (жидкого) вещества, г/моль,  ,
, 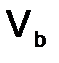 - объем газообразного вещества (н.у.), л,
- объем газообразного вещества (н.у.), л, 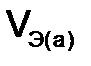 ,
,  -молярный объем эквивалента газообразного вещества (н.у.), л/моль (дм3/моль).
-молярный объем эквивалента газообразного вещества (н.у.), л/моль (дм3/моль). ) – это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях.
) – это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях. ,
,  (8)
(8) - молярная масса элемента, г/моль;
- молярная масса элемента, г/моль;  - валентность элемента в данном соединении, fэ – фактор эквивалентности.
- валентность элемента в данном соединении, fэ – фактор эквивалентности.
 ,
,  (9)
(9) - молярная масса кислоты,
- молярная масса кислоты, 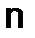 - число атомов водорода вступивших в реакцию.
- число атомов водорода вступивших в реакцию.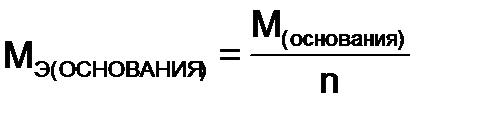 ,
,  - молярная масса основания,
- молярная масса основания, 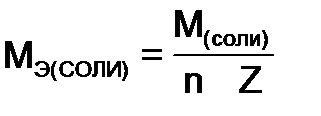 ,
,  - молярная масса соли,
- молярная масса соли, 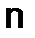 - число атомов металла образующего соль;
- число атомов металла образующего соль;  - валентность металла.
- валентность металла. ,
, 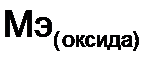 - молярная масса оксида,
- молярная масса оксида, 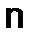 - число атомов элемента образующего оксид,
- число атомов элемента образующего оксид,  ,
,  ,
,  ,
, 

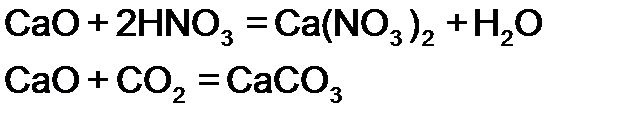

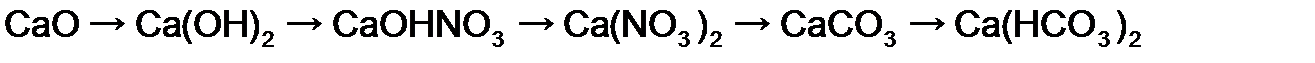
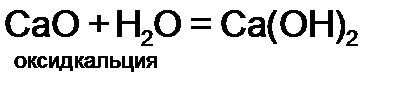
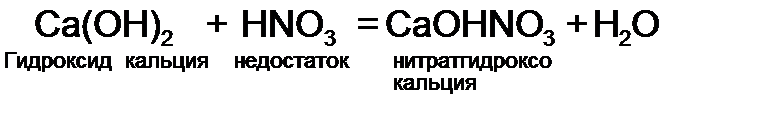
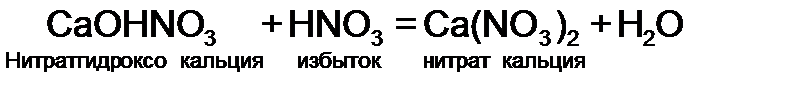
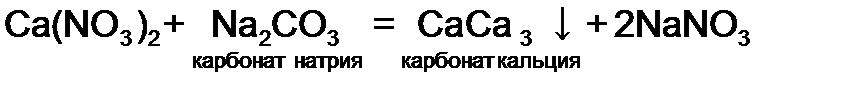
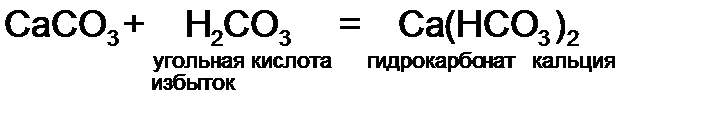
 .
.
 - гидроксид кальция, основание. Расчет ведем по формуле (10):
- гидроксид кальция, основание. Расчет ведем по формуле (10):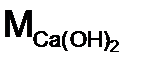 = 40 + 2·(16 + 2) = 76 г/моль
= 40 + 2·(16 + 2) = 76 г/моль , имеются две гидроксидные группы (ОН), то в случае замещения в реакции одной из них n = 1
, имеются две гидроксидные группы (ОН), то в случае замещения в реакции одной из них n = 1 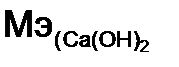 = 76/1= 76 г/моль, а двух, n = 2
= 76/1= 76 г/моль, а двух, n = 2  – серная кислота. Расчет ведем по формуле (9):
– серная кислота. Расчет ведем по формуле (9): = 2 + 32 + 16·4 = 98 г/моль,
= 2 + 32 + 16·4 = 98 г/моль,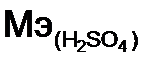 =98/1 =98 г/моль, а двух n = 2,
=98/1 =98 г/моль, а двух n = 2,  –нитрат магния, соль. Расчет ведем по формуле (11):
–нитрат магния, соль. Расчет ведем по формуле (11):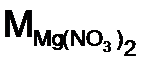 = 24 + 2·(14 + 16·3) = 148 г/моль; n = 1 (количество атомов металла), Z = 2 (валентность металла)
= 24 + 2·(14 + 16·3) = 148 г/моль; n = 1 (количество атомов металла), Z = 2 (валентность металла) = 148/ 2 = 74 г/моль
= 148/ 2 = 74 г/моль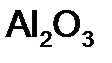 – оксид алюминия. Расчет ведем по формуле (12):
– оксид алюминия. Расчет ведем по формуле (12):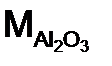 = 27·2 + 16·3 = 102 г/моль; n = 2 (количество металла), Z = 3 (валентность металла)
= 27·2 + 16·3 = 102 г/моль; n = 2 (количество металла), Z = 3 (валентность металла)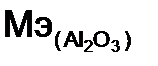 = 102 / 6 = 17 г/моль
= 102 / 6 = 17 г/моль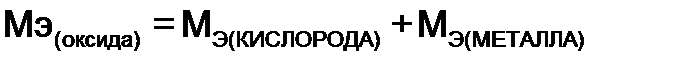 , можно найти молярную массу эквивалентов металла:
, можно найти молярную массу эквивалентов металла: 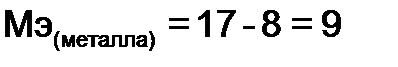 г/моль, по закону эквивалентов формула (4) найдем количество металла, вступившего в реакцию: m (металла)= 9,43×9/ 17=4,99 г
г/моль, по закону эквивалентов формула (4) найдем количество металла, вступившего в реакцию: m (металла)= 9,43×9/ 17=4,99 г
 = 7,09·11,2 / 2,24 = 35,45 г/моль
= 7,09·11,2 / 2,24 = 35,45 г/моль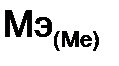 =
= 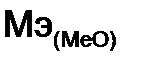 -
-  =35,45–8=27,45 г/моль.
=35,45–8=27,45 г/моль.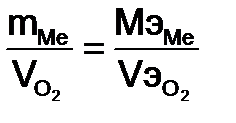 ;
; 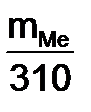 =
= 
 = 310·12,16: 5600 = 0,673 г
= 310·12,16: 5600 = 0,673 г ;
;
 = 15 г/моль.
= 15 г/моль.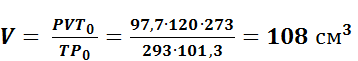 .
. ,
, 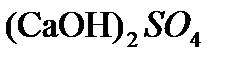
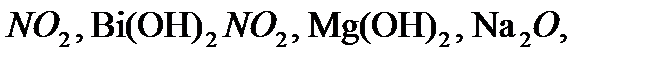



 ,
, 
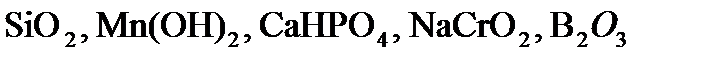 ,
, 
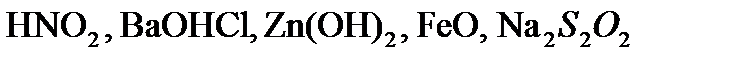 ,
, 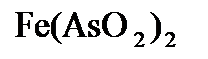
 ,
, 
 ,
, 
 ,
, 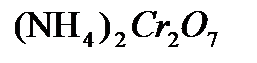
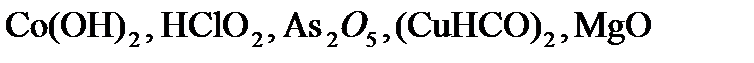 ,
, 
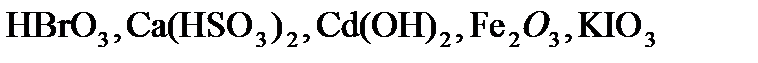 ,
, 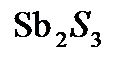
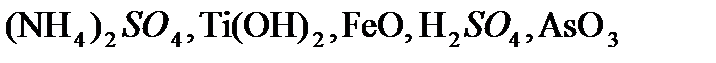 ,
, 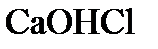
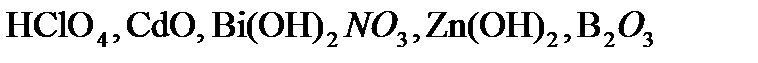 ,
, 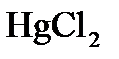
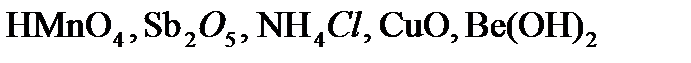 ,
, 
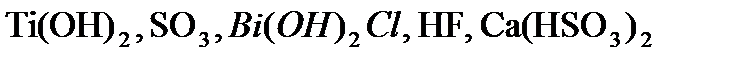 ,
, 





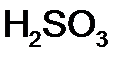




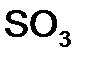


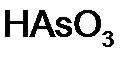
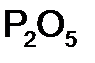

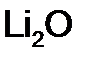
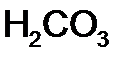
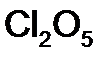






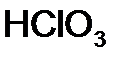

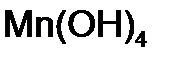
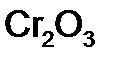

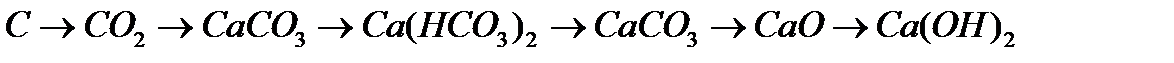
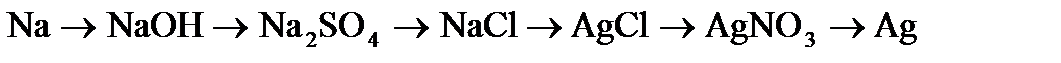
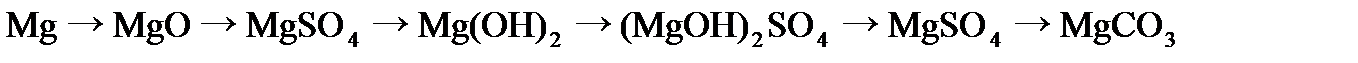
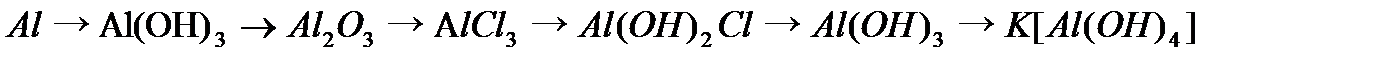
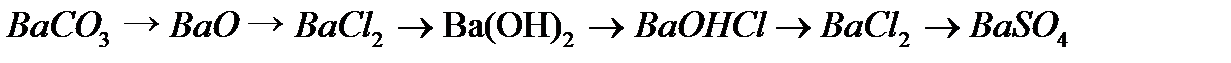


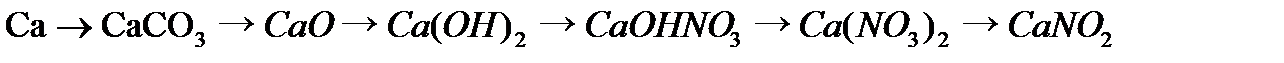

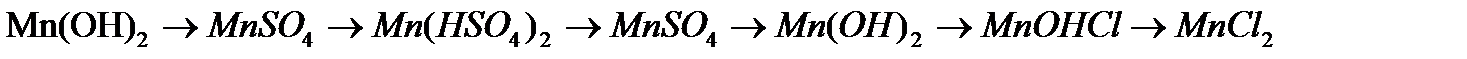
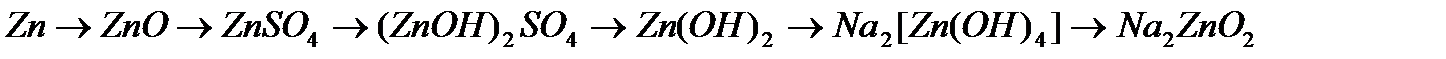



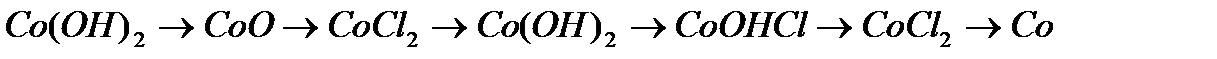
 ,
, 
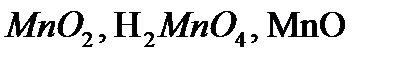 ,
, 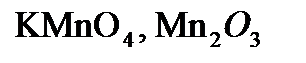
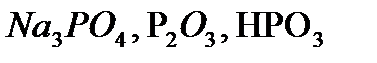 ,
, 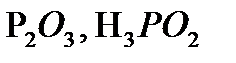
 ,
, 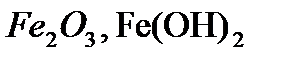
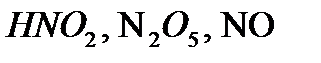 ,
, 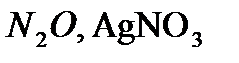
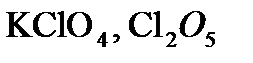 ,
, 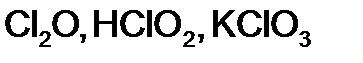
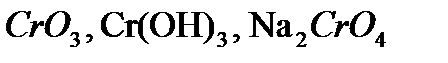 ,
, 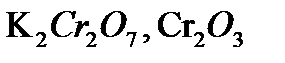
 ,
, 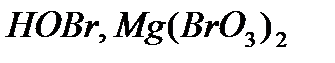
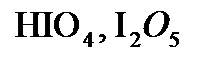 ,
, 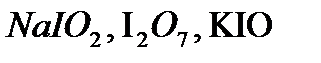

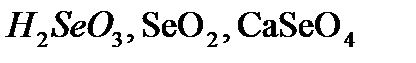
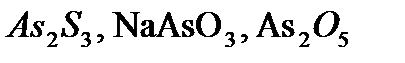 ,
, 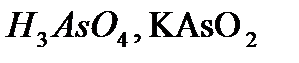
 ,
, 
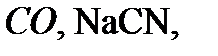
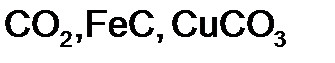
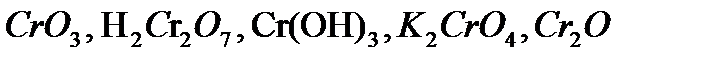
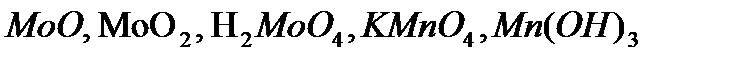
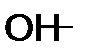 ) (табл. 18).
) (табл. 18).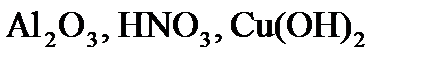 ,
, 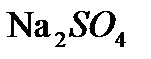

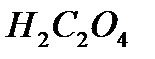
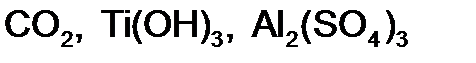
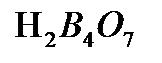


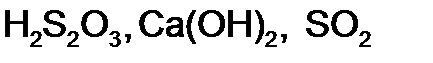
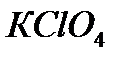
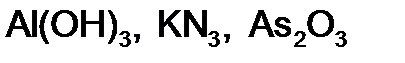


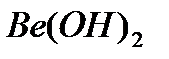

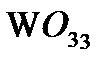

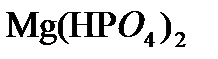

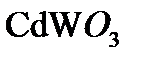
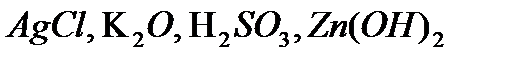
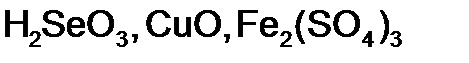 ,
, 
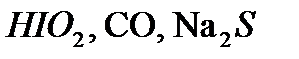 ,
, 
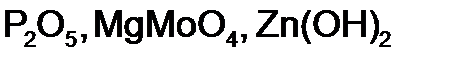 ,
, 
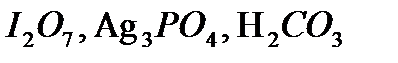 ,
, 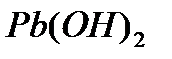
 в
в 
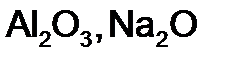 г
г 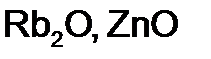
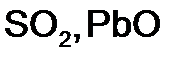 в
в  г
г 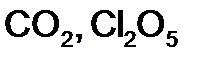
 в
в 
 г
г 
 в
в 
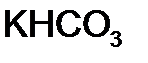 г
г 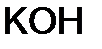
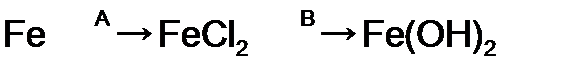 , реагенты А и В соответственно ‑ это
, реагенты А и В соответственно ‑ это в
в  Cl2,
Cl2, г
г 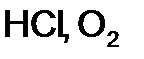
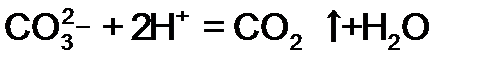 , отвечает взаимодействию реагентов
, отвечает взаимодействию реагентов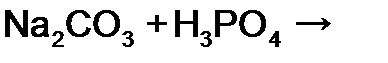 в
в 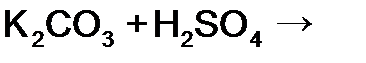
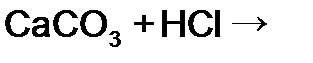 г
г 
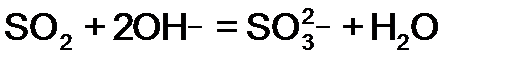 , ион среды (гидроксид ОН-) может отвечать реагенту
, ион среды (гидроксид ОН-) может отвечать реагенту в
в 
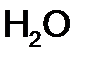 г.
г. 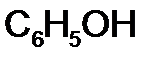

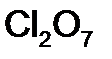




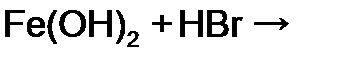
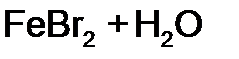
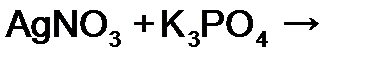
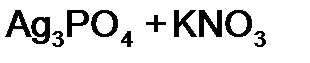

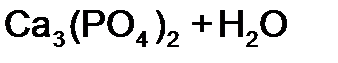
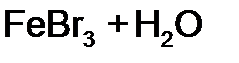
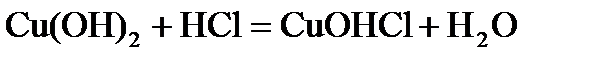 равна:
равна: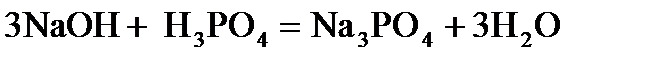 равна:
равна:


