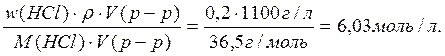Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молярная масса эквивалентов веществаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Молярной массой эквивалентов вещества Х называется масса одного моля (или 6,02·1023) его эквивалентов. Она обозначается М [1/z* (Х)] и измеряется в г/моль или в кг/моль. Молярную массу эквивалентов вещества можно рассчитать по формуле:
М [1/z* (Х)]= где М (Х) – молярная масса вещества Х.
Если фактор эквивалентности равен единице, то молярные массы вещества и его химического эквивалента численно совпадут. Химическое количество эквивалентов вещества Химическое количество эквивалентов вещества Х называется отношение массы вещества (m) к молярной массе его эквивалента (М [1/z* (Х)]:
С учётом того, что М [1/z* (Х)] =
Единицей измерения химического количества вещества эквивалентов является моль. Молярная концентрация эквивалентов вещества Молярной концентрацией эквивалентов вещества Х называется отношение химического количества эквивалентов вещества n[1/z*(X)] к объему раствора (V), в котором оно находится. Она обозначается c[1/z*(X)] и рассчитывается по формуле:
Молярная концентрация химического эквивалента в системе СИ измеряется в моль/м3 или в моль/дм3 (моль/л). Молярная концентрация вещества и молярная концентрация его химических эквивалентов вещества связаны следующим отношением: c[1/z*(X)] = z*·c(X) Если число эквивалентности равно единице, то молярная концентрация вещества и его эквивалентов численно совпадают:
c[1/z*(X)] = c(Х)
Во всех других случаях молярная концентрация эквивалентов вещества в z раз больше молярной концентрации вещества. На практике, кроме молярной концентрации эквивалентов вещества (особенно в титриметрии), часто используют так называемый титр раствора (Т): Т(Х) = Титр имеет размерность г/см3 и показывает, сколько граммов вещества содержится в 1см3 раствора. Между молярной концентрацией эквивалентов вещества и титром раствора существует следующая зависимость:
Т(Х) =
c[1/z*(X)] =
Зная титр раствора и его объем, можно определить массу растворенного вещества в растворе. Закон эквивалентов К реакциям, протекающим в стехиометрических соотношениях и заканчивающихся полным расходованием исходных веществ применим закон эквивалентов, который можно сформулировать следующим образом:
Количества эквивалентов исходных веществ Х1 и Х2, вступивших между собой в химическую реакцию, равны друг другу и химическим эквивалентам образовавшихся в результате реакции конечных продуктов, т.е. n[1/z*(X1)] = n[1/z*(X2)] где n[1/z*(X1)] – количество вещества эквивалента реагента Х1; n[1/z*(X2)] – количество вещества эквивалента реагента Х2.
Если мы знаем массы расходованных исходных веществ и молярные массы их химических эквивалентов, то в этом случае закон эквивалентов можно записать иначе:
где m(X1) и m(X2) – массы исходных веществ Х1 и Х2, соответственно; M[1/z*(X1)] и M[1/z*(X2)] – молярные массы эквивалентов исходных веществ.
Если взаимодействуют между собой растворы веществ Х1 и Х2, и мы знаем их использованные объёмы (V(X1), V(X2)), молярные концентрации эквивалентов вещества c[1/z*(X1)] и c[1/z*(X2)], то закон эквивалентов записывается иначе:
c[1/z*(X1)]·V1 = c[1/z*(X2)]·V2
Такая математическая форма записи закона эквивалентов используется в титриметрическом методе анализа. Следует отметить, что в литературе, посвященной титриметрическому анализу, до сих пор часто используется устаревшая форма обозначения молярной концентрации эквивалентов вещества с помощью заглавной латинской буквы N. В этом случае закон эквивалентов запишется так:
N1V1 = N2V2
где N1 и N2 – молярные концентрации эквивалентов веществ, называемые иначе нормальными концентрациями, или нормальностью растворов.
Практическая часть занятия Примеры расчета молярной концентрации эквивалента (нормальной концентрации). Пример 1. Рассчитать молярную концентрацию эквивалента натрий гидроксида в растворе, в 100 мл которого содержится 0,5 г NaОН.
m (NaOH) = 0,5 г V (р-р) = 100 мл = 0,1 л М (NaOH) = 40 г/моль
fэкв.(NaOH) = 1 M[1/z*(NaOH)] = fэкв.(NaOH) · M(NaOH) = 1 · M(NaOH) = M(NaOH) c[1/z*(NaOH)] = Ответ: Молярная концентрация эквивалентов NaOH в растворе равна 0,125 моль/л
Пример 2. Рассчитать молярную концентрацию эквивалентов HCl в 20% растворе соляной кислоты (r= 1,1 г/см3).
ω(HCl) = 20% или 0,2 r= 1,1 г/см3 = 1100 г/л M (HCl) = 36,5 г/моль
fэкв.(HCl) = 1 M[1/z*(HCl)] = fэкв.(HCl) · M(HCl) = 1 · M(HCl) = M(HCl) c[1/z*(HCl)] =
Массовая доля – это отношение массы вещества к массе раствора: ω(HCl)= m(HCl)= m(p-p)·ω(HCl)
ρ =
c[1/z*(HCl)] = Ответ: молярная концентрация эквивалентов HCl в 20% растворе равна 6,03 моль/л.
2. Контролирующие задания 1. Укажите единицу количества вещества эквивалента: а) килограмм б) сантиметр кубический в) моль г) литр 1. Какое значение может принимать фактор эквивалентности HCN в кислотно-основных реакциях ионного обмена? а) 1/2 б) 1/5 в) 1 г) 1/8 2. Какое количество эквивалентов составляют 49 г фосфорной кислоты в реакции образования средней соли? а) 3 б) 2 в) 1,5 г) 1 4. В 1 кг воды растворили 212 г Na2CO3. Плотность полученного раствора равна 1,212 г/мл. Фактор эквивалентности соли равен ½. Определите: а) массовую долю Na2CO3; б) молярную концентрацию; в) нормальную концентрацию; г) моляльность; д) титр раствора соли. 5. В лаборатории имеется 3М раствор КСl. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей КСl 8% и плотностью 1,05 г/мл. Ответ: 75,2 мл. 6. Рассчитайте объем раствора гидроксида натрия с плотностью 1,15 г/мл и ω(NaOH) = 10%, необходимый для приготовления 250 мл 0,08 М раствора. 7. Определите, чему равен фактор эквивалентности восстановителя или окислителя в следующих превращениях: 1) Сг2О7 2– → 2Сг3+ 2) NO3 – → NO2 – 3) MnO4– → MnO2 4) ВгО3– → Вr - 8. В каждой реакции укажите окислитель, восстановитель и определите для них факторы эквивалентности: 1) MnO2 + KClO3 + KOH ® K2MnO4 + KCl + H2O 2) H2Se + K2Cr2O7 + H2SO4 ® Se + Cr2(SO4)3 + K2SO4 + H2O 3) Cr(OH)3 + Br2 + KOH ® K2CrO4 + KBr +H2O 4) AsH3 + KMnO4 + H2SO4 ® H3AsO4 + MnSO4 + K2SO4 + H2O 5) Na2SO3 + KMnO4 + H2O ® MnO2 + Na2SO4 + KOH
|
||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 1105; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.218.44 (0.008 с.) |



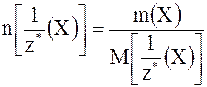

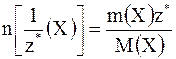
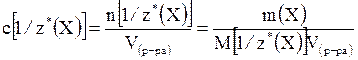

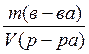 =
= 


 Дано:
Дано: c[1/z*(NaOH)] =?
c[1/z*(NaOH)] =?
 Дано:
Дано: c[1/z*(HCl)] =?
c[1/z*(HCl)] =?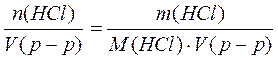
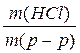 , откуда находим:
, откуда находим: , то m(p-p) = ρ ∙ V (p-p), тогда:
, то m(p-p) = ρ ∙ V (p-p), тогда: