Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы приготовления рабочих растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Рабочие растворы, с помощью которых в титриметрии определяют концентрации растворённых веществ, исследователь перед анализом должен приготовить сам. Они могут быть получены тремя способами. 1. Путём растворения точно рассчитанной (исходя из заданной концентрации) и взвешенной на специальных аналитических весах массы вещества в заданном объёме раствора. Соединения, которые используются для приготовления таких растворов, должны: а)быть химически чистыми и не содержать посторонних примесей; б)иметь постоянный состав, строго соответствующий их химической формуле; в)быть устойчивыми при хранении как в чистом виде, так и в растворе, т.е. самопроизвольно не разлагаться и не взаимодействовать с окружающей средой (кислородом, углекислым газом, водяными парами и другими веществами, содержащимися в воздухе); г)легко растворяться в Н2О; д)иметь большую молярную массу эквивалентов (чем она больше, тем меньше ошибка при взвешивании). Лишь немногие соединения удовлетворяют или почти удовлетворяют этим требованиям, поэтому число веществ, пригодных выступать в качестве первичных стандартов, ограничено. Титранты, полученные данным способом, называются рабочими растворами с приготовленным титром или стандартными растворами. При втором способе получения рабочих растворов рассчитанную навеску вещества взвешивают на технических весах, растворяют в известном объёме раствора, а затем его точную концентрацию путём титрования определяют или устанавливают с помощью стандартного раствора. Такие титранты называются рабочими растворами с установленным титром, или стандартизированными растворами. Вещества, которые используются для получения данных растворов, могут медленно разлагаться при хранении, взаимодействовать с окружающей средой, поэтому точно рассчитанную навеску взвесить практически не представляется возможным. Например, многие кислоты (H2SO4, HNO3, HCl) активно поглощают водяные пары из воздуха, а щёлочи взаимодействуют с содержащимся в нём углекислым газом. Концентрацию рабочих растворов с установленным титром определяют непосредственно перед анализом. При их хранении необходимо принимать все возможные меры, чтобы титр раствора не изменился. Однако даже при соблюдении самых тщательных мер предосторожности концентрацию такого рабочего раствора нужно проверять каждые 2-3 недели.
3. Рабочие растворы можно приготовить также из фиксаналов. Фиксанал (нормадоза или стандарт-титр) представляет собой запаянную стеклянную ампулу, содержащую строго определённое химическое количество эквивалентов вещества в сухом виде или в растворе. Чаще всего такая ампула содержит 0,1 и 0,01 моль эквивалентов вещества и используется для приготовления 1 литра раствора. Для чего содержимое ампулы количественно переносится в соответствующую мерную колбу и разбавляется Н2О до метки (рис. 4). При этом сразу получается стандартный раствор. Правила работы с мерной посудой при проведении При проведении объёмно-аналитических измерений в титриметрии применяется специальная мерная посуда: мерные колбы, пипетки, бюретки, мерные цилиндры и пробирки. Работа с ней требует определённых навыков и умений. Для получения правильных результатов в объемном анализе все операции необходимо выполнять очень тщательно, используемая посуда должна быть чистой и соответствовать целям и задачам проводимых измерений.
Мерные колбы Мерные колбы – этот тонкостенные плоскодонные круглые сосуды с длинным узким горлышком, на котором нанесена метка в виде тонкой кольцевой черты. Они бывают разной вместимости: от 25 см3 до 2 дм3 (рис. 3).
Рис. 3. Мерные колбы
Мерные колбы предназначены для приготовления растворов точной концентрации (т.е. стандартных растворов), а также для разбавления уже имеющихся растворов до указанных объёмов. Сухие навески (в том числе содержимое фиксаналов) или имеющийся раствор (при его разбавлении) вносят в мерную колбу через воронку, смывая затем остаток вещества с воронки (и ополаскивая ампулу фиксанала) дистиллированной водой (рис. 4). Для растворения внесённого вещества в колбу добавляют дистиллированную воду (примерно до половины её объёма). Вращательными движениями содержимое колбы тщательно перемешивают, пока не образуется однородный раствор. После этого добавляют через воронку очередную порцию воды, пока уровень жидкости не станет ниже круговой метки на горлышке колбы на 3-5 мм. Затем оставшуюся часть воды добавляют по каплям и доводят объём раствора точно до метки. Для правильного измерения объёма жидкости в мерной колбе (и в другой мерной посуде) необходимо, чтобы глаз наблюдателя и круговая метка на её горлышке находились в одной и той же горизонтальной плоскости (рис. 5).
Рис. 4. Приготовление рабочего раствора из фиксанала
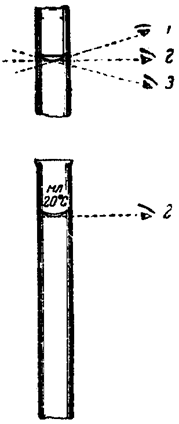
Рис. 5. Отсчет уровня жидкости в сосуде при разных положениях глаза: 2 – правильное положение глаза, 1, 3 – неправильное Объём прозрачных жидкостей отмеривают по нижнему краю их мениска (который должен совпадать с круговой меткой колбы), а интенсивно окрашенных (например, раствор KMnO4) – по верхнему. Хранить полученный раствор в мерной колбе не рекомендуется. После приготовления его необходимо перенести в предназначенный для этих целей стеклянный сосуд, снабжённый хорошо притёртой стеклянной пробкой. Пипетки Пипетки предназначены для отбора небольших, точно отмеренных объёмов жидкости, и переноса их из одного сосуда в другой. Различают пипетки Мора, градуированные пипетки и автоматические пипетки, называемые иначе пипеточными дозаторами (рис. 6, 10).
Рис. 6. Пипетки: а – простая (пипетка Мора); б - градуированная
Пипетки Мора представляют собой стеклянную трубочку с оттянутым носиком и с расширением в средней части. Они предназначены для отбора строго определённого объёма жидкости, который цифрой указан на одной из стенок расширения. Градуированные пипетки предназначены для отмеривания различных небольших объёмов жидкости с помощью шкалы, нанесённой на их стенку. Они тоже представляют собой стеклянные трубки с оттянутым носиком. Для отбора пипеткой Мора и градуированной пипеткой необходимого объёма жидкости и переноса его в другой сосуд поступают следующим образом: 1. На горлышко пипетки насаживают резиновую грушу, сжимают её до полного удаления воздуха. Затем пипетку помещают в сосуд с отбираемым раствором (как можно глубже, вплоть до касания носиком пипетки дна сосуда), отпускают грушу и ждут пока уровень жидкости в пипетке не поднимется на 3-4 см выше верхней нулевой отметки. 2. Снимают грушу. Быстро закрывают верхнюю часть пипетки (или её горлышко) указательным пальцем и, удерживая саму пипетку большим и средним пальцами, быстро достают её из сосуда с раствором (рис. 7).
Рис. 7. Как следует (а), и не следует (б) держать пипетку
Держа пипетку вертикально над поверхностью раствора, ослабляют нажим указательного пальца на её горлышко, так чтобы жидкость медленно капала из носика пипетки в раствор, пока нижняя часть её мениска (или верхняя, если раствор интенсивно окрашен) не сравняется с верхней нулевой меткой на стенке пипетки. После этого нажим на горлышко пипетки быстро усиливают до полного прекращения истечения жидкости (рис. 8).
Рис. 8. Положение пипетки при установлении мениска на уровне черты Для удаления капли жидкости, оставшейся на внешней стороне носика пипетки, касаются им внутренней стенки сосуда с отбираемым раствором. 3. Пипетку переносят в другой сосуд (чаще всего в колбу для титрования) и, ослабив нажим указательного пальца, дают из неё вытечь нужному объёму жидкости (рис. 9).
Рис. 9. Выливание раствора из пипетки
В последнее время всё более широко применяются пипеточные дозаторы или автоматические пипетки. Это специальные устройства, которые позволяют точно отобрать нужный объём жидкости из раствора с помощью простого нажатия на кнопочное устройство, находящееся в их верхней части (рис. 10).
Рис. 10. Пипеточный дозатор
Необходимый для отбора переменный объём жидкости устанавливается с помощью цифрового дисплея, расположенного на рукоятке пипетки. Перед работой с пипеточным дозатором необходимо внимательно прочитать инструкцию по его эксплуатации. Данные устройства являются более удобными по сравнению с пипетками Мора и градуированными пипетками, они позволяют быстрее осуществлять отбор заданного объёма жидкости и к настоящему времени превалируют в повседневной практике научных и исследовательских лабораторий. Единственным недостатком пипеточных дозаторов является их гораздо более высокая стоимость по сравнению с обычными стеклянными пипетками. Бюретки В титриметрии бюретки используются для постепенного прибавления с регулируемой скоростью одного раствора к другому с последующим измерением общего объёма расходованной при этом жидкости. Таким образом, с помощью бюреток непосредственно осуществляется сам процесс титрования. Бюретка представляет собой узкую стеклянную трубку, на которую нанесена шкала (рис. 11).
Рис. 11. Бюретки
В лабораторной практике обычно используются бюретки ёмкостью 25-50 см3 (с ценой деления 0,1 см3). Для измерения малых объёмов жидкостей применяются бюретки емкостью от 1 до 5 см3 (с ценой деления 0,01 см3). Такие бюретки называются микробюретками (рис. 12).
Рис. 12. Микробюретка с краном: 1 – деревянный штатив; На нижнем конце бюретки находится стеклянный пришлифованный кран (рис. 11 а), или небольшое овальное расширение, на которое плотно надевается резиновая трубка со стеклянным, оттянутым в капилляр, концом. Резиновая трубка зажимается металлическим зажимом или стеклянной бусиной, представляющей собой стеклянный шарик с диаметром немного больше внутреннего диаметра резиновой трубки (рис. 11 б, в). Шарик помещается внутри трубки между концом бюретки и оттянутым стеклянным капилляром. Нажимая большим и указательным пальцами на резиновую трубку возле шарика, образуют внутри ее узкий просвет, через который жидкость вытекает из бюретки с большей или меньшей скоростью (рис. 11 г). У бюреток, снабжённых краном, кран смазывают очень тонким слоем вазелина, следя за тем, чтобы вазелин не попал в канал крана. Перед титрованием бюретку нужно подготовить в работе. Для этого её тщательно моют, ополаскивают несколько раз дистиллированной H2O, а затем раствором, которым она должна наполняться. Бюретку закрепляют в штативе в вертикальном положении, заполняют с помощью воронки нужным раствором до 2/3 её объёма. В кране или резиновой трубке и в наконечнике не должно оставаться пузырьков воздуха. Чтобы удалить их, нужно несколько раз быстро открыть и закрыть кран (зажим) и спустить жидкость сильной струёй. В бюретках со стеклянным шариком для удаления воздуха отгибают вверх резиновую трубку с капилляром и нажимают на шарик. Жидкость выливается через загнутую вверх резиновую трубку и вытесняет из неё и капилляра весь воздух (рис. 13).
Рис. 13. Удаление воздуха из капилляра бюретки
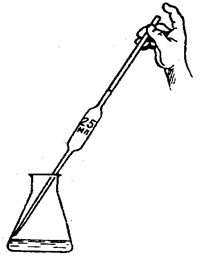
Убедившись в полном удалении воздуха, бюретку снова заполняют жидкостью – сначала выше нулевого деления, а затем, открыв кран либо зажим или надавив на шарик, точно до нулевого деления. Отсчёты уровня светлых жидкостей производят по их нижнему мениску, а тёмных – по верхнему. При выполнении нескольких измерений в каждом из них все отсчёты делают аналогичным образом. Проведение титрования С помощью пипетки отмеряют, а затем переносят в колбу для титрования соответствующий объём раствора. Если титрование осуществляют в присутствии индикатора, то в колбу для титрования добавляют несколько его капель (как правило, 1-2 капли). Приготовленную таким образом колбу помещают на белом фоне под бюреткой (рис. 14).
Рис. 14. Положение колбы и бюретки при титровании
Нажимая большим и указательным пальцами левой руки на шарик бюретки, добавляют в колбу небольшими порциями второй раствор. При этом правой рукой осторожно встряхивают колбу для быстрого перемешивания раствора. Вблизи точки эквивалентности раствор в колбе в месте падения капли раствора из бюретки на некоторое время приобретает окраску, характерную для точки эквивалентности. Это может служить признаком приближающегося конца реакции титрования. В этом случае раствор из бюретки начинают прибавлять по одной капле, каждый раз внимательно наблюдая окраску смеси в колбе. После стойкого (неисчезающего) изменения окраски титрование прекращают и записывают показание объема жидкости в бюретке. Первое титрование служит для ориентировочного установления объёма и при расчётах не используется. Титрование с тем же исходным объёмом раствора в колбе проводят ещё не менее трёх раз. Перед началом каждого нового опыта уровень жидкости в бюретке снова доводят до нулевой отметки. Первую порцию жидкости при повторном титровании спускают из бюретки одномоментно (объём её должен быть немного меньше 0,5-1 мл) результата первого титрования. После этого дотитровывают раствор по каплям до наступления точки эквивалентности. По результатам нескольких измерений рассчитывают средний объём раствора, пошедшего на титрование.
Практическая часть занятия 1. Определить цену деления пипетки. 2. При помощи градуированной пипетки отмерить: а) 5 мл дистиллированной воды; б) 8,7 мл дистиллированной воды; в) 0, 4 мл дистиллированной воды. 3. Определить цену деления бюретки. 4. Заполнить бюретку дистиллированной водой и отмерить: а) 3 мл дистиллированной воды; б) 6,2 мл дистиллированной воды; в) 0,8 мл дистиллированной воды.
Вывод: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________ Дата ___________ Подпись преподавателя___________
|
||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 974; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.009 с.) |