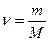Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготовление растворов заданной концентрацииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы: приобретение навыков приготовления растворов заданной концентрации, выраженной различными способами, из сухой соли или более концентрированного раствора. Оборудование и реактивы: конические колбы на 250 мл, технохимические весы, фильтровальная бумага, мерные цилиндры, набор ареометров, мерные колбы на 100 мл, сухие соли, например NaCI, KCI, Na2CO3, BaCI2, CaCI2, CuSO4.
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Концентрация раствора- это относительное содержание растворенного вещества в растворе. Для выражения концентрации растворов существует два способа. I. долевой способ: а) массовая доля вещества ω, безразмерная величина или выражается в процентах, вычисляют по формуле
где m(в-ва), масса вещества, г; m(р-ра), масса раствора, г. б) мольная доля χ, величина безразмерная или выражается в процентах, вычисляют по формуле
где ν(в-ва), количество вещества, моль; ν1 + ν2 +…, сумма количеств всех веществ в растворе, моль. в) объемная доля φ, величина безразмерная или выражается в процентах, вычисляют по формуле
где V(в-ва), объем вещества, л; V(смеси), объем смеси, л. II. концентрационный способ: а) молярная концентрация CM, моль/л, вычисляют по формуле
где ν(в-ва), количество вещества, моль; V(р-ра), объем раствора, л. б) нормальная концентрация СН, моль/л, вычисляют по формуле
где ν(экв), количество вещества эквивалента, моль; V(р-ра), объем раствора, л; Z, фактор эквивалентности. в) моляльная концентрация Сb, моль/кг, вычисляют по формуле
где ν(в-ва), количество вещества, моль; m(р-ля), масса растворителя, кг. г) титр Т, г/мл, вычисляют по формуле
где m(в-ва), масса вещества, г; V(р-ра), объем раствора, мл. Обычно вызывает затруднение изучение свойств растворов (осмос и осмотическое давление, понижение давления насыщенного пара, понижение температуры кристаллизации и повышение температуры кипения растворов), а также свойств растворенных веществ — растворимости и произведения растворимости. Осмос- это односторонняя диффузия веществ из растворов через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два раствора различной концентрации. В системе растворитель-раствор молекулы растворителя могут перемещаться через перегородку в обоих направлениях. Но число молекул растворителя, переходящих в раствор в единицу времени, больше числа молекул, перемещающихся из раствора в растворитель. Давление, которое надо приложить, чтобы скорости обоих процессов были равными, называют осмотическим. Растворы, характеризующиеся одинаковым осмотическим давлением, называются изотоническими. Осмотическое давление определяют согласно закону Вант-Гоффа
где ν, количество вещества, моль; R, газовая постоянная, равная 8,314 Дж/(моль·К); Т, абсолютная температура, К; V, объем раствора, м3 Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением
где P0, давление пара над чистым растворителем; P, давление пара растворителя над раствором; n, количество растворенного вещества, моль; N, количество растворителя, моль. Повышение температуры кипения и понижение температуры замерзания растворов по сравнению с чистым растворителем, согласно закону Рауля, пропорциональны моляльной концентрации растворенного вещества неэлектролита ∆Т= КСb где Сb, моляльная концентрация, моль/кг; К, коэффициент пропорциональности. В случае повышения температуры кипения раствора К называется эбулиоскопической константой, в случае понижения температуры замерзания- криоскопической константой. Эти константы, численно различные для одного и того же растворителя, характеризуют повышение температуры кипения и понижение температуры замерзания одномоляльного раствора, т.е. при растворении 1 моль нелетучего неэлектролита в 1000 г растворителя. Растворимость S показывает, сколько граммов вещества может раствориться в 100 г воды при данной температуре. Растворимость твердых веществ с ростом температуры, как правило, возрастает, а для газообразных веществ – уменьшается. Для перехода от массы раствора к его объему и наоборот нужно знать величину плотности. Плотность выражается в г/см3 (г/мл), кг/м3, г/л, и др. Для приближенного и быстрого определения плотности служит ареометр или денсиметр (см. рис. 1).
В состоянии равновесия выталкивающая сила, действующая на ареометр, уравновешивается силой тяжести: Fвыт.= mg или рж·V·g = mg, отсюда V = m/рж,. Итак, объем вытесненной жидкости (или глубина погружения) обратно пропорционален плотности жидкости рж. На этом и основано измерение плотности ареометром. Жидкость наливают в чистый цилиндр. Из набора выбирают ареометр, который погружается на такую глубину, чтобы уровень жидкости в цилиндре находился в пределах шкалы ареометра. Ареометр не должен касаться дна и стенок цилиндра. Показания следует снимать по нижнему краю мениска в случае прозрачной жидкости, и по верхнему - в случае непрозрачной. Зная плотность раствора, по специальным таблицам (см. табл. 1) можно определить массовую долю раствора, и наоборот, зная концентрацию раствора, определить его плотность.
Рис. 1. Определение плотности жидкости при помощи ареометра
Таблица 1 Массовая доля (ω%) и плотность (р) растворов солей при 20°C
Если в таблице отсутствует необходимое значение величины, то применяют метод интерполяции (нахождение промежуточного значения величины по известным крайним значениям). В данном случае применяется линейная интерполяция: считается, что в узких интервалах зависимость между плотностью и концентрацией линейна. Это является, в некоторой степени, приближением. В действительности возможны и отклонения от линейности. Допустим, нужно определить плотность 2,3% раствора хлорида натрия. Такой концентрации в таблице нет. Ближайшие значения массовой доли - 2% и 4%, им соответствуют плотности растворов 1,0125 г/см3 и 1,0226 г/см3. Следовательно, при изменении концентрации на 2%, плотность раствора изменится на 1,0226-1,0125=0,0101 г/см3. Составив пропорцию, найдем, как изменится плотность при изменении концентрации на 0,3%: 2% — 0,0101 г/см3 0,3% — х г/см3 Из пропорции х=0,0015 г/см3. Прибавив эту величину к значению плотности 2%- ного раствора, получим плотность 2,3%- ного раствора: 1,0125+0,0015=1,0140 г/см3. МЕТОДИКА ПРОВЕДЕНИЯ ОПЫТОВ Опыт 1 Приготовление раствора с заданной массовой долей соли
Получите у преподавателя задание и рассчитайте, сколько граммов соли и миллилитров воды потребуется для приготовления раствора заданной концентрации. Покажите расчеты преподавателю и получите разрешение на проведение опыта. Взвесьте на технохимических весах нужную массу соли и высыпьте ее в коническую колбу на 250 мл. Отмерьте цилиндром необходимый объем воды и влейте его в колбу с солью. Перемешивайте содержимое колбы до полного растворения соли. Перелейте в цилиндр приготовленный раствор. При помощи ареометра измерьте его плотность рэксп.. Найдите по табл. 1 плотность раствора ртабл., соответствующую заданной концентрации. Вычислите относительную ошибку опыта:
Рассчитайте молярную концентрацию, молярную концентрацию эквивалента, моляльную концентрацию и титр приготовленного раствора. Результаты опыта и расчетов сведите в табл. 2. Таблица 2 Результаты опыта 1
Опыт 2 Приготовление раствора с заданной массовой долей из более концентрированного раствора
В качестве более концентрированного раствора используется раствор, приготовленный в опыте 1. Получите у преподавателя задание. Определите плотность заданного раствора по табл. 1. Рассчитайте объем более концентрированного раствора соли и объем воды, необходимые для приготовления раствора заданной концентрации. Покажите расчеты преподавателю и получите разрешение на выполнение опыта. Отмерьте цилиндром рассчитанный объем более концентрированного раствора соли и долейте водой до необходимого объема. Приготовленный раствор тщательно перемешайте, переливая из цилиндра в колбу и обратно. При помощи ареометра измерьте плотность раствора рэксп.. Вычислите относительную ошибку опыта аналогично опыту 1. Результаты опыта сведите в табл. 3. Таблица 3 Результаты опыта 2
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1 Массовая доля растворенного вещества. Определите массовую долю в (%) хлорида калия в растворе, содержащем 0,053 кг KCI в 0,5 л раствора, плотность которого 1063 кг/м3. Решение
Массовую долю вещества находим по формуле
где m(в-ва), масса вещества, г; m(р-ра), масса раствора, г. Масса раствора равна произведению объема раствора V на его плотность ρ m=Vρ, тогда массовая доля хлорида калия в растворе равна:
Пример 2 Молярная концентрация раствора. Какова масса NaOH, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,2 моль/л? Решение
Молярную концентрацию вещества находят по формуле
где ν(в-ва), количество вещества, моль; V(р-ра), объем раствора, л. Количество вещества ν вычисляют по формуле
где m, масса вещества, г; М, молярная масса вещества, г/моль. Тогда масса NaOH, содержащегося в растворе, равна
НЕОБХОДИМЫЙ УРОВЕНЬ ПОДГОТОВКИ СТУДЕНТОВ 1. Знать способы выражения концентрации растворов. 2. Уметь определять плотность раствора при помощи ареометра. 3. Уметь пользоваться таблицами зависимости плотности растворов от массовой доли растворенного вещества. 4. Уметь производить расчеты, необходимые для приготовления растворов заданной концентрации, выраженной различными способами. 5. Уметь готовить растворы заданной концентрации из сухого вещества и воды; из более концентрированного раствора и воды. 6. Уметь находить массу или количество растворенного вещества, исходя из концентрации раствора. 7. Уметь производить расчеты, связанные с переходом от одного способа выражения концентрации раствора к другому. ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ 1. Сколько граммов гидроксида калия нужно растворить в 600 мл воды для получения 16% раствора? Плотность раствора равна 1,15 г/мл. 2. Какой объем 4% раствора хлорида кальция (плотность см. в табл. 1) требуется для взаимодействия с 120 мл 0,1 М раствора AgNO3? 3. Определите массовую долю растворенного вещества в 2,64 н. растворе серной кислоты. Плотность раствора серной кислоты равна 1,080 г/мл. 4. Какие объемы 12% раствора и 3% раствора хлорида натрия нужно смешать для получения 120 мл 8% раствора? При решении задачи воспользоваться данными табл. 1.
ЛИТЕРАТУРА 1. Н.Б.Любимова. Вопросы и задачи по общей и неорганической химии. -М.: Высш. шк., 1990. - С. 174 - 179. 2. Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. -М.:Высш. шк., 1991. -С.101-104. Лабораторная работа № 8
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 802; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.78.184 (0.012 с.) |

 %
% %
%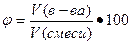 %
%
 или
или 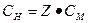

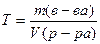
 ,
,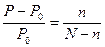 ,
, Ареометр представляет собой поплавок с дробью и узкой трубкой. На трубке имеется шкала, проградуированная в единицах плотности. Ареометр погружается в различные жидкости или растворы различной концентрации на разную глубину. При этом вытесняются различные объемы жидкостей, но массы их всегда одинаковы, они равны массе ареометра.
Ареометр представляет собой поплавок с дробью и узкой трубкой. На трубке имеется шкала, проградуированная в единицах плотности. Ареометр погружается в различные жидкости или растворы различной концентрации на разную глубину. При этом вытесняются различные объемы жидкостей, но массы их всегда одинаковы, они равны массе ареометра.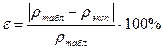
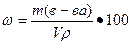
 .
.