Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготовление и денсиметрический анализ раствора заданной концентрацииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Задание. Приготовить 100 мл водного раствора соли, концентрация и состав которого указаны преподавателем. Определить плотность полученного раствора и рассчитать по значению плотности фактическую концентрацию раствора. Найти относительную ошибку опыта из сравнения исходной и измеренной концентрации. Здесь предстоит творческая и сугубо индивидуальная работа. Каждый студент сам готовит свой раствор определенной концентрации, сам его (раствор) анализирует и сравнивает результат анализа с тем, что было приготовлено. Приборы и посуда: ареометр, термометр, мерная колба, мерный цилиндр, часовое стекло, промывалка. Реактивы: сухая соль, дистиллированная вода. Ход работы. Как и в некоторых предыдущих лабораторных работах направляющая и руководящая роль в систематизации наших действий закодирована в виде таблицы 12. Ее надо заполнить по собственным результатам. Отметим, что работа сугубо индивидуальная. 1. Колонку 1 заполняем под диктовку преподавателя. Это эксклюзивные данные. В нашем примере студент Т. получил задание приготовить 100 мл раствора поваренной соли, концентрация которого 0,76 моль/л. Таблица 12
2. Прежде, чем хвататься за соль и мерную посуду, надо выяснить, сколько брать предложенной преподавателем соли. Дана молярная концентрация, а готовить надо 100 мл раствора. Придется вычислить, сколько же граммов соли для этого надо. Следует решить задачу: сколько граммов соли содержится в 100 мл предназначенного вам раствора. Можно поискать прототип такой задачи в консультационной части этой методички, можно доверить решение соседу или соседке (но у них своя задача и придется униженно ждать, когда знаток освободится), а можно смело взяться за построение самолетика. Перевод молей в граммы, как и раньше, осуществляем с использованием молекулярной массы своей соли (а не соли студента Т.). При подсчете молекулярной массы используем данные Периодической системы об атомных массах. Используемые значения атомных масс округляем до целых единиц. Только для хлора берем 35,5.(Напоминаем, что округление – это не всегда отбрасывание цифр после запятой. Надо учитывать значимость этих цифр.) Молекулярную массу кристаллогидрата вычисляем путем сложения молекулярной массы безводной соли с массой соответствующего количества молекул воды.
Из «самолетной» пропорции вычисляем необходимую массу соли с точностью до 3-го знака после запятой. Результат записываем в колонку 2 таблицы 12 и округляем (а не просто отбрасываем последнюю цифру) до второго знака после запятой, так как химико-технические весы все равно не позволяют взвешивать точнее. Весь свой расчет (естественно он сделан в рабочем журнале, а не на клочке бумажки) показываем преподавателю. Если все в порядке, – тщательно отслеживаем, чтобы преподаватель в нужной графе своего журнала против нужной фамилии поставил точку. Если будут ошибки (а они бывают в округлениях, сложениях, умножениях и других торопливых действиях), то придется их устранять. Ведь понятно, что ошибка в этом расчете массы соли не позволит получить раствор заданной концентрации. На этом этапе вам преподаватель поможет отыскать ошибку полетов, не снижая итоговой оценки. Получив одобрение преподавателя, плавно перемещаемся в весовую комнату для взятия навески своей соли. Берем с собой тетрадку, где в колонке 2 (табл. 12) записана нужная масса, и листок бумаги, который будет служить тарой. При взвешивании обращаем внимание на измельченность соли. Крупных частиц в навеске быть не должно. При необходимости используем фарфоровую ступку. Чем мельче соль, тем меньше будет потерь при переносе ее в колбу и тем быстрее произойдет растворение. Приготовление раствора. Переносим навеску соли в мерную колбу через сухую стеклянную или самодельную бумажную воронку. Пересыпаем соль медленно и аккуратно. Быстрота в данном случае замедлит дальнейшую работу, т.к. даже мелкие, а тем более и крупные частицы соли (их не должно быть в навеске) могут забить носик воронки. Очистка воронки «съест» много времени. Здесь справедливо правило: «не спеши – будешь первым». Во время этой ответственной процедуры мерная колба должна покоиться на чистом листе бумаги для «улавливания» просыпанных крупинок соли. Эти потери тоже надо отправить в колбу.
Заполняем б о льшую половину мерной колбы дистиллированной водой из промывалки и добиваемся растворения соли путем перемешивания. Перемешивание эффективно проводить не встряхиванием, а вращательными движениями, ухватив тремя пальцами колбу за верхнюю часть ее длинного горла. Примерно так, как мы размешиваем чайной ложечкой сахар в стакане. Если с самого начала мы «набухали» воды до самого горла мерной колбы, то перемешивание будет затруднено, и процесс растворения затянется. После полного растворения соли, доводим объем раствора до метки (риски), опять таки приливая дистиллированную воду. Здесь легко перестараться, а отлить лишнюю воду возможности не будет. Поэтому последние («горловые») капли воды приливаем не из промывалки, а из бутыли с дистиллированной водой, которая находится над раковиной и имеет специальный зажим (он называется зажим Мора). Последние капли должны довести нижний край мениска до риски. При этом риска должна находиться на уровне глаз. Именно такой уровень соответствует индивидуальной калибровке мерной колбы. Проводим финальное перемешивание раствора методом «кувыркания». Некоторые потери на смачивание «пальца-пробки» уже не страшны, так как для измерения плотности не обязательно иметь 100 мл раствора. 3. Определение плотности раствора. Плотность раствора определяется ареометром. Это прибор поплавкового типа. Его глубина погружения в жидкость в соответствии с законом Архимеда зависит от плотности жидкости. Ознакомьтесь с устройством ареометра, выясните цену большого и малого делений. Учтите интервал плотностей, который измеряет каждый ареометр из предоставленного вам набора. Расположите их в порядке возрастания интервала плотностей (от более легкого к более тяжелому). Перелейте свой раствор из мерной колбы в высокий цилиндр. Осторожно опустите в него самый легкий ареометр. Если его откалиброванная шейка окажется выше уровня жидкости, то возьмите более тяжелый ареометр. Надо подобрать ареометр так, чтобы уровень жидкости попал в зону шкалы ареометра. Если вы начнете с более тяжелого ареометра, то он утонет, и у вас будут проблемы с его спасением. После того как положение выбранного ареометра установится, рукой его не удерживаем и производим отсчет. Следим, чтобы во время отсчета ареометр не прилипал к стенкам цилиндра. Деление, против которого находится верхний край мениска жидкости, соответствует плотности раствора. Во время отсчета глаз наблюдателя должен находиться на уровне мениска. С помощью ареометра плотность определяется с точностью до 0,001 г/мл. Для проведения повторных измерений ареометр приподнимаем над раствором на 1 – 2 см, позволяем ему опять погрузиться и снова снимаем показания. Добиваемся сходимости показаний и заносим результат в колонку 3 таблицы 12. Студент Т. получил для своего раствора r= 1,025 г/мл. До и после измерений ареометр ополаскиваем дистиллированной водой и обтираем фильтровальной бумагой. Обращаемся с ареометром, как с дорогим хрустальным изделием, - с осторожностью и с полной серьезностью.
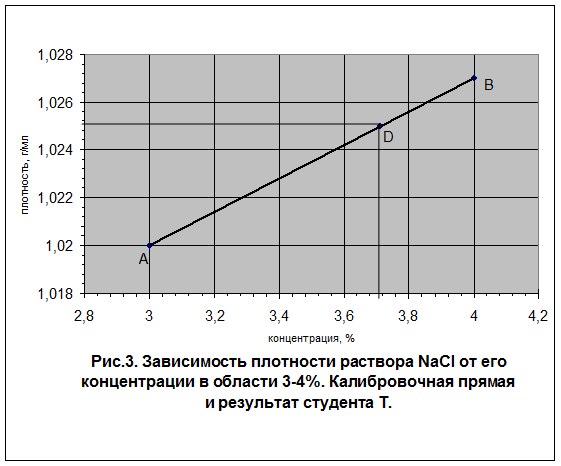
На этом «мокроскляночная» часть работы заканчивается. Приступаем к обработке результатов. 4. Нахождение процентной концентрации по плотности Процентную концентрацию приготовленного раствора находим по таблице, в которой для данной плотности раствора указана процентная концентрация. Для растворов NaCl такая таблица (под №4) представлена в приложении 2. Для других растворов соответствующие таблицы имеются в лаборатории. Выясним, как студент Т. из своей плотности нашел процентную концентрацию своего раствора. Окидывая внимательным взором таблицу 4 приложения 2, он с удовлетворением обнаружил, что измеренная им плотность раствора NaCl (1,025 г/мл) соответствует процентной концентрации между 3 и 4%. Точное значение концентрации своего раствора студент Т. нашел методом графического интерполирования. Для этого в координатах плотность – концентрация он построил на миллиметровке калибровочную прямую (см. рис. 3). Плотности для двух реперных точек А и В, отвечающих концентрациям 3% и 4% он взял из табл.4 приложения 2. Именно их он выбрал потому, что его плотность лежит в диапазоне плотностей 1,020 – 1,027. Никакие другие точки (в том числе и нулевые) ему для построения калибровочного графика не нужны. , Масштаб Т. подобрал так, чтобы суметь отсчитать необходимую концентрацию с точностью до 0,01%. Здесь не надо мельчить, но целесообразно, чтобы масштаб был удобен для расчетов. Неудобно например, когда на 1% приходится 4 или 6 см. Лучше 5 или, если помещаются, то 10 см. Аналогично, но независимо следует продумать и масштаб для оси плотностей. На ней в данном случае указываются только значения в интервале 0,007 г/мл (от 1,020 до 1,027 г/мл). Никаких нулевых концентраций наносить на график не надо. Работаем только в зоне измеренной плотности. Естественно калибровочная прямая не проходит через начало координат, а лишь через две реперные точки. После построения калибровочной прямой студент Т. вздохнул и нашел с помощью обыкновенной линейки, что его раствору с измеренной плотностью 1,025 г/мл соответствует точка D. А этой точке на оси концентраций соответствует значение 3,71% (ось абсцисс). Эта величина была уверенно занесена в левую часть колонки 4 в табл. 12. Чтобы заполнить правую часть колонки 4 студент Т. решил задачку: какова молярность раствора NaCl, который содержит 3,71% безводной соли и имеет плотность 1,025 г/мл. Для этого он соорудил в сторонке самолетик, заполнил его «пассажирами» с нужными наименованиями, решил пропорцию и нашел молярность своего раствора, равную 0,65 моль/л.
Студенты, готовившие раствор из кристаллогидрата, при пересчете из процентной концентрации в молярную концентрацию (внутри колонки 4) должны брать для окончательного расчета молярную массу безводной соли, а не кристаллогидрата, так как кристаллизационная вода «рассосалась» по всему раствору. 5. Нахождение ошибки измерения Студент Т. готовил раствор с концентрацией 0,76 моль/л. (Потому что такое задание он получил от преподавателя). Оказалось же, по данным его измерений, что получился раствор с концентрацией 0,65 моль/л. Разность этих величин есть абсолютная ошибка. Для ее расчета обычно от большей величины отнимают меньшую. В данном случае абсолютная ошибка составляет 0,11 моль/л. Конечно, совершенно безграмотным будет отнимать моли от процентов. Чтобы не совершить этот вопиющий проступок, осмотрительный Т. пересчитал найденную из графика процентную концентрацию в молярную. В колонку 5 таблицы 12 надо вставить относительную ошибку. Она показывает, сколько процентов составляет абсолютная ошибка (у Т. 0,11) от измеренной величины (у Т. 0,65). Отыскав у коллег калькулятор, имеющий опцию для вычисления процентов, студент Т. вышел на финишный параметр 16,9% и направился с результатами и графиком к преподавателю. Получив желанный балл, студент Т. стал оказывать дружескую помощь студенту Д. Вопросы для обсуждения при сдаче лабораторной работы. 1. Что такое плотность раствора, в каких единицах ее выражают? 2. Что такое графическое интерполирование? 3. Как рассчитать навеску соли для приготовления данного количества раствора указанной молярности? 4. Какие виды концентраций вы знаете? Что они означают? 5. Как рассчитывают абсолютную и относительную ошибки определения? 6. Что такое раствор, чем он отличается от тонкодисперсной смеси? 7. Почему одни вещества растворяются, а другие нет? 8. Почему растворы кипят при более высокой температуре, а замерзают при более низкой температуре, чем чистые растворители? Почему этот температурный сдвиг имеет разное направление? Лабораторная работа № 6
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1082; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.53.18 (0.011 с.) |