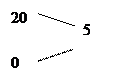Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила приготовления растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В лабораторной диагностике применяются в основном растворы реагентов, приготовленные на дистиллированной воде. Для получения дистиллированной воды используют специальные приборы – аквадистилляторы. В ряде случаев (если требует методика) используют бидистиллированную воду, то есть перегнанную дважды, а также деионизированную воду. Для получения воды с заданными свойствами удобно использование специальных коммерческих систем. Для некоторых анализов требуется вода, не содержащая СО2 (в частности, для рН-метрии). В этом случае бидистиллят кипятят в течение 5 – 10 мин, охлаждают без доступа воздуха и используют в течение нескольких часов. Приготовление раствора включает взвешивание необходимого количества реактива с последующим растворением в растворителе (чаще в воде). Количество растворителя отмеривается с помощью специальной мерной посуды – цилиндров, мерных колб, а при малых количествах – автоматическими пипетками. Количественный состав раствора определяется его концентрацией. Концентрацию можно выразить как количество или массу (вес) вещества, содержащееся в определенном объеме жидкости. В клинико-диагностических лабораториях наиболее широко используют «процентные» и «молярные» растворы. Процентным принято называть раствор, в 100мл которого содержится определенное количество грамм вещества. Например, 5% раствор хлористого натрия подразумевает, что в 100 мл раствора содержится 5 г NaCl. Если раствор приготавливают из вещества с известной молекулярной массой, то для расчета концентрации используют единицу количества вещества (моль). Такие растворы называют «молярные» (молярность – число молей растворенного вещества, содержащихся в 1 л раствора). В ряде случаев возникает потребность в получении приблизительных растворов путем разбавления более концентрированных. Для этого удобно пользоваться способом, именуемым «правилом креста» Например, если требуется получить 5% раствор хлористого натрия из более концентрированного (20%) составляют первую запись:
где 20 – показатель концентрации взятого раствора, 0 – вода, 5 – требуемая концентрация. Из 20 вычитают 5 и полученное значение записывают в правом нижнем углу. Разность между 0 и 5 записывают в правом верхнем углу. После этого схема принимает следующий вид:
Это означает, что для получения 5% раствора необходимо 5 частей 20% раствора смешать с 15 частями воды (например, 5 мл и 15 мл, 5 л и 15 л и т.д.). Если требуется приготовить раствор промежуточной концентрации из двух исходных растворов, то в вышеприведенной схеме вместо нуля (левый нижний угол) ставится концентрация второго раствора. Например, надо приготовить 20% раствор из 35% и 10%. В этом случае схема будет иметь вид:
Это означает, что для приготовления 20% раствора требуется взять 10 частей 35% раствора и 15 частей 10% раствора. В случае, когда расходные материалы для исследований готовятся на основании двух растворов реактивов, обычно указывают какое количество частей одного раствора (А) необходимо смешать с определенным количеством частей другого раствора (В). Такой подход, в частности, используют при приготовлении буферных растворов (см. ниже). Возможно также обозначать соотношение частей в растворе знаком «двоеточие» (:). Так, запись «спирт:эфир 1:2» означает, что данная смесь получена путём смешивания 1 объёма спирта и двух объемов эфира. Мерой объема при этом может быть любая величина, в зависимости от требуемого количества расходного материала (например, мл, л и т.д.). Для приготовления многих растворов в качестве растворителя используются буферные растворы – водные растворы, сохраняющие определенную концентрацию ионов Н+ (рН) при добавлении небольших количеств сильных кислот и щелочей. Буферные растворы представляют собой растворы слабой кислоты и ее соли, или слабого основания и его соли, взятых в определенном соотношении. Буферные растворы также можно составлять из смеси солей многоосновной кислоты, константы диссоциации которой сильно отличаются друг от друга, например, из смеси одно- и двузамещенных фосфатов. Например, широко используемый для работы с клетками крови фосфатный буфер (рН 5,8-8,2) приготавливается следующим образом: Р-р А: Динатриевый фосфат 1/15 М: растворить 11,876 г Na2НРО4 х 2Н2О или 23,882 г Na2НРО4 х 12Н2О в 1000 мл воды. Р-р В: КН2РО4 1/15 М: растворить 9,078 г КН2РО4 в 1000 мл воды. Для получения буфера с определенной рН необходимо смешать растворы А и В в нижеуказанных соотношениях:
Продолжение таблицы
При разведении (до соотношения 1:100) рН буферного раствора практически не меняется, однако отражается на его емкости. Буферная емкость – число молей сильной кислоты или сильного основания, добавление которого к буферному раствору изменяет его рН на единицу. Фактически это характеристика способности раствора противостоять прибавлению кислоты или щелочи. Буферная емкость тем больше, чем концентрированнее раствор. Для приготовления буферных растворов необходимо использовать перекристаллизованные реактивы квалификации “хч” и бидистиллированную воду; значение рН – контролировать потенциометрически (см. ниже). Перекристаллизация (восстановление кристаллической структуры реагента) достигается путем прокаливания. Необходимость кристаллизации диктуется тем, что при неправильном хранении реактивов (кристаллогидратов) может происходить частичная потеря кристаллизационной воды (выветривание), из-за чего вещество переходит в аморфное состояние. Такой реактив без предварительного прокаливания не пригоден к приготовлению растворов, так как исходно закладывается ошибка при подсчете молекулярной массы кристаллогидрата. С увеличением температуры константа диссоциации воды возрастает, соответственно увеличивается и концентрация водородных ионов, а рН уменьшается. Поэтому когда указывается точная концентрация водородных ионов в растворе или оптимальный рН какой-либо химической реакции, должна быть указана и температура, к которой эта величина относится, иначе сведения носят лишь приблизительный характер. Буферные растворы используются в тех случаях, когда анализ проводится при определенном значении рН, в частности при определении активности ферментов. Приготовление растворов из фиксаналов Фиксанал представляет собой ампулу, содержащую навеску (либо концентрат) вещества, из которого необходимо приготовить раствор заданной концентрации (молярный, нормальный или процентный). Каждая ампула фиксанала рассчитана на приготовление раствора в определенном объеме растворителя (количество растворителя указывается на этикетке фиксанала). Приготовление растворов производится в соответствии с инструкцией к фиксаналу, выполнение которой обеспечивает полное перенесение вещества в раствор. Целый ряд веществ, переходя из недиссоциированного состояния в ионизированное, меняет цвет, поэтому окраска раствора зависит от рН. Эти вещества называются кислотно-щелочными индикаторами. Они принадлежат к различным типам органических соединений, но все являются слабыми кислотами или слабыми основаниями. Их недиссоциированные молекулы окрашены иначе, чем диссоциированные. Индикаторы могут использоваться как добавки к растворам реактивов для контроля за изменением рН. Например, в растворе Хенкса (среда, используемая для работы с клетками) в качестве индикатора добавлен феноловый красный. В диапазоне нейтральной рН раствор имеет оранжево-красный цвет, при закислении среды – меняется на желтый, а при защелачивании – на малиновый. При хранении растворов надо иметь в виду, что основными причинами, которые могут привести к случайному изменению рН, являются попадание угольной кислоты из воздуха и выщелачивание стекла. Углекислота воздуха сказывается главным образом на растворах, рН которых выше 7, поскольку более кислые растворы угольную кислоту не поглощают. Уберечься от ее влияния проще всего, закрывая флаконы с реактивами пробками. Выщелачивание посуды зависит в первую очередь от сорта стекла, а также от длительности хранения реактива. Оценить его влияние в условиях клинической лаборатории непросто, поэтому надо проявлять определенную осторожность. Пластмассовые флаконы, пробирки и кюветы, как правило, делаются из материала, который не выщелачивается. В лабораториях растворы реактивов обычно приготавливают на несколько дней (до нескольких недель). Стабильность растворов зависит от их концентрации. При необходимости длительного хранения лучше готовить концентраты растворов (например, 10х кратные), так как они более стабильны. Растворы, необходимые непосредственно для работы (рабочие растворы), готовят накануне путем разбавления матричных растворов и используют в течение одного или нескольких дней. Определение рН растворов Ориентировочное представление о рН раствора можно получить с помощью лакмусовой полоски или по изменению цвета индикатора (см. выше). Однако для контроля рН в реакциях, требующих строго определенной концентрации водородных ионов, необходимо применение более точных методов. В клинической лабораторной диагностике для этих целей используются потенциометрические методы. К потенциометрии относятся различные варианты приборов для исследования рН и кислотно-щелочного состояния, а также ионселективные электроды. Потенциометрические методы основаны на измерении электрического потенциала, который возникает на границе двух сред в том случае, когда ионы одного заряда проникают через эту границу легче, чем противоположно заряженные. Это различие обусловлено свойствами специальной мембраны с избирательной проницаемостью, разделяющей два раствора – один известного состава (эталонный), другой – исследуемый. Оба раствора посредством солевых мостиков, то есть трубочек, заполненных раствором соли (обычно хлористым калием), контактируют с металлическими электродами, на границе которых с раствором всегда одна и та же разность электрических потенциалов. Материал металлического электрода (его называют полуэлемент) и состав раствора, в который он погружен, подбираются таким образом, чтобы величина этого потенциала была максимально устойчивой. Наиболее часто в качестве полуэлементов используют хлорсеребряные электроды – кусочки серебряной проволоки, покрытые слоем хлористого серебра. Исправный хлорсеребряный электрод должен быть темного цвета, когда он портится, хлористое серебро осыпается и видна светлая металлическая поверхность. Конструктивно ионоселективные электроды изготовляют так, что эталонный раствор (или заменяющая его масса плотной консистенции, которая ведет себя как эталонный раствор) вместе с мембраной объединены в один блок с металлическим электродом (полуэлементом), к которому подведен электрический провод. Вторая половина электрической цепи также изготовляется в виде отдельного блока, который называется электродом сравнения или референтным. На границе растворов электролитов разных концентраций, разделенных перегородкой с избирательной проницаемостью, ионы из более концентрированного раствора диффундируют в менее концентрированный, но через полупроницаемую перегородку могут проходить ионы только одного заряда. Поэтому на границе раздела возникает разность потенциалов, которую фиксирует прибор (рисунок 2.2).
Рисунок 2.2 – Принцип потенциометрических измерений А – электрод сравнения (референтный). В – измерительный электрод (индикаторный). 1 – исследуемый раствор; 2 – ионоселективная мембрана (избирательно пропускает определенные виды ионов); 3 - эталонный раствор; 4 – хлорсеребряный электрод. Электроды очень чувствительны к попаданию посторонних веществ – щелочей, кислот, поверхностно-активных веществ, дезинфицирующих агентов, а также к нагреванию. Они имеют ограниченный срок работы (со временем теряют чувствительность) и нуждаются в постоянной и систематической калибровке. Фильтрование Фильтрованием называется отделение от жидкости находящихся в ней частиц при помощи фильтрующей перегородки. Жидкость, отделяемая при фильтровании, называется фильтратом. Существуют различные фильтрующие материалы, а также различные способы фильтрования. В биохимических лабораториях наиболее часто используются фильтрование через бумажные фильтры. Такой вид фильтрования называют поверхностным. Частицы остаются на поверхности фильтра, если размеры превышают размер диаметра пор. Фильтровальная бумага, в отличие от обычной бумаги, более чиста по составу и волокниста, что и обусловливает ее фильтрующую способность. Фильтровальная бумага бывает обычная и беззольная. Фильтры, приготовленные из беззольной бумаги, при сжигании дают очень незначительное количество золы (оно указывается на фабричной этикетке на каждой пачке). Беззольную бумагу употребляют при точных аналитических работах, связанных со сжиганием осадка вместе с фильтром. В клинико-диагностических лабораториях чаще используют обычные фильтры. Плотность фильтра условно обозначают определенным цветом бумажной ленты, которой оклеивают упаковку. Приняты следующие обозначения: 1. Розовая или черная лента – быстро фильтрующая бумага. Предназначена для отделения студенистых осадков, например гидроокисей металлов. 2. Белая лента – бумага средней проницаемости. Используется в лабораториях в большинстве случаев. 3. Синяя лента – плотные фильтры. Применяются для фильтрования мелкозернистых осадков. Фильтрование идет очень медленно. 4. Желтая лента – обезжиренные фильтры. Применяются при исследованиях липидов. Обычно в методике, по которой проводится то или иное количественное определение, указано, какой плотности фильтр надо выбрать. В качестве фильтрующего материала могут быть использованы многослойные материалы – хлопок, стекловолокно и другие. При этом частицы задерживаются как на поверхности, так и в глубине фильтра, поэтому такой вид фильтрования называют «глубоким». Обычное фильтрование происходит под влиянием силы тяжести. При этом скорость фильтрации, как правило, небольшая, и существенно зависит от характера фильтрующего материала, размера пор, размера частиц в растворе. Для фильтрования при комнатной температуре и атмосферном давлении применяют стеклянные воронки. Воронку располагают таким образом, чтобы ее носик немного входил в емкость для фильтрата и прикасался к его стенке. При этом конец трубки должен быть на достаточной высоте от дна емкости, чтобы при наполнении емкости фильтратом трубка воронки не была погружена в жидкость. В воронку вставляют фильтр такого размера, чтобы его края были ниже краев воронки на 0,5–1 см. Затем смачивают фильтр водой, прижимают пальцем плотно к стеклу и начинают фильтрование. Если жидкость проходит свободно через фильтр, надо раствор лить непрерывно. Если жидкость проходит через фильтр медленно, новую порцию доливают, когда бόльшая часть жидкости пройдет через фильтр. Для увеличения скорости фильтрования можно использовать фильтрование под вакуумом. При этом к действию силы тяжести добавляется сила всасывания. Для вакуумной фильтрации применяют специальные фильтры с повышенной плотностью. В простейшем виде фильтрование под вакуумом можно реализовать с помощью водоструйного насоса, к которому присоединяют колбу Бунзена. Одним из вариантов фильтрования является так называемая «ультрафильтрация». Она осуществляется через фильтры с чрезвычайно узкими порами, через которые проходят молекулы небольшого размера, но задерживаются крупные молекулы (например, белки). Использование таких фильтров помогает повысить концентрацию макромолекул (например, концентрацию белков в биологическом материале). В настоящее время широкое применение получают фильтры с заданным размером пор, изготовленные из полимерных материалов – целлюлозы, полвинилхлорида, полиамида, нейлона и др. Их называют мембранные фильтры. Выбор материала и размера пор зависит от цели применения фильтра. Наиболее широко используют фильтры с размером пор 0,45 μm и 0,2 μm для предстерилизации и стерилизации сред для культивирования и реактивов. Мембранные фильтры с размером пор, соизмеримым с размерами клеток (5-8 μm) могут использоваться для сепарации клеток.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 3511; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.70.108 (0.012 с.) |