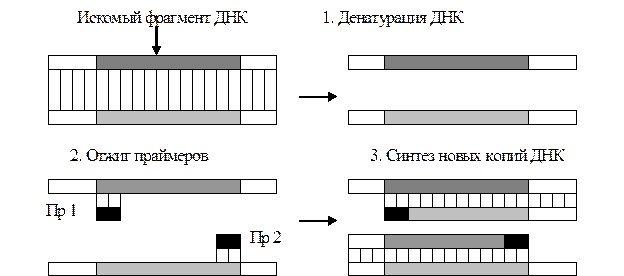Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярно-биологические методы исследованийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Молекулярно-биологические исследования – группа методов, предназначенных для детекции в биологическом материале нуклеиновой кислоты (РНК, ДНК). В основе молекулярно-биологических исследований лежит воспроизведение механизма дублирования наследственной информации в геноме. Последовательность нуклеотидов в одиночной цепи ДНК или РНК закономерно воспроизводится в последовательности нуклеотидов комплементарной цепи благодаря исключительным биологическим свойствам азотистых оснований и специфических ферментных систем. Технология амплификации, то есть производства множества копий ДНК из участка искомой ДНК или РНК, в клинико-диагностических лабораториях наиболее широко используется в формате полимеразной цепной реакции (ПЦР). Полимеразная цепная реакция была разработана сотрудником американской компании «Cetus» К. Мюллисом в 1983 г. Спустя 10 лет за это открытие ему была присуждена Нобелевская премия. В основе ПЦР лежит комплементарное достраивание ДНК-матрицы (репликация ДНК), осуществляемое in vitro с помощью фермента ДНК-полимеразы. Число копий специфического фрагмента ДНК увеличивается экспоненциально. Благодаря этому, последовательности, присутствующие в изучаемом материале в минимальном количестве (например, при исследовании клеток всего одна аномальная последовательность на 100 тыс – 1 млн клеток) и не поддающиеся обнаружению никакими другими методами, легко выявляются с помощью ПЦР. Организация лаборатории для ПЦР и правила работы регламентируются нормативными документами. Требования к площади: 2 – 3 несмежных помещения общей площадью не менее 20-30 м2, оснащенных водопроводом и приточно-вытяжной вентиляцией. В случае использования электрофореза для разделения ампликонов, три процедуры (подготовка анализируемых проб, амплификация и детекция результатов) должны быть физически изолированы друг от друга для предотвращения контаминации, и проводиться в разных помещениях, оснащенных предбоксами. Работа проводится в лабораторной одежде, сменяемой при переходе из одного помещения в другое. Минимальный комплект оборудования (при электрофоретической детекции результатов): амплификатор (термоциклер); термостат для термоподготовки проб; настольная центрифуга; центрифуга-вортекс; камера для электрофореза; источник питания для электрофореза; трансиллюминатор («столик с подсветкой») для просмотра гелей, ламинарный бокс. ПЦР-диагностика включает следующие этапы: ¨ подготовка образца для тестирования; ¨ постановка и проведение собственно ПЦР (проведение реакции, направленной на накопление объекта исследования – амплификация); ¨ оценка результата (детекция ампликонов). Подготовка образца для тестирования включает взятие материала и выделение мишеневой ДНК. Для проведения ПЦР необходимо выбрать биологический материал, с наибольшей вероятностью содержащий искомую ДНК (РНК). При этом для получения адекватных результатов большое значение имеет качество взятия образца для исследования, его хранение, транспортировка и предварительная обработка. ПЦР-анализ относится к прямым методам лабораторного исследования – образец анализируется на наличие ДНК (например, возбудителя). Поэтому для ПЦР-анализа пригоден любой клинический материал, потенциально содержащий возбудителей инфекций (соскоб эпителиальных клеток, мазок, плазма крови, сыворотка, лейкоцитарная масса, осадок мочи, слюна, спинномозговая жидкость, биоптаты и др.). При взятии биопроб для ПЦР-диагностики инфекционных заболеваний необходимо соблюдать следующие общие рекомендации: · Взятие материала производить из предполагаемого места обитания микробов. При этом учитывать, что различные микроорганизмы имеют свои особенности локализации, пути распространения и выделения. · Взятие биологического материала производить, по-возможности, в период обострения инфекции. За 10 дней до взятия материала на исследование необходимо прекратить прием химиопрепаратов и лечебные процедуры. У женщин материал следует брать перед менструацией или через 1-2 дня после ее окончания, причем накануне обследования женщины не должны проводить туалет наружных половых органов и спринцевание. Взятие биоматериала для контроля эффективности лечения должно проводиться не ранее чем через 3-4 недели после окончания терапии. · Количество материала, забираемого для исследования, не должно быть избыточным, так как вместе с возбудителем в пробу попадают вещества, которые могут вызвать ингибирование ПЦР или способствовать деградации ДНК при хранении и транспортировке. При взятии мазков и соскобов наиболее адекватным инструментом является специальный урогенитальный зонд (щеточка), который собирает необходимое количество эпителия, не травмируя слизистую, и хорошо отдает собранный материал в жидкую транспортную среду. · Для взятия биопроб необходимо пользоваться только одноразовым инструментом и одноразовыми пластиковыми контейнерами (или пробирками с транспортной средой) с плотно закрывающейся или завинчивающейся крышкой. · При использовании венозной крови получают материал натощак из локтевой вены в одноразовую пластиковую пробирку с антикоагулянтом (ЭДТА иди цитрат натрия; гепарин использовать не рекомендуется) при необходимости исследования плазмы или без него (если предполагается исследовать сыворотку). Для исследования необходимо 1 мл отделенной плазмы или сыворотки. Биологический материал, доставленный в ПЦР-лабораторию, исследуется в течение 2-х часов, а при необходимости сохраняется в замороженном виде (-18…-200С) в течение 2-х недель (допускается только одно замораживание-оттаивание материала). Для проведения ПЦР-анализа доставленный материал подвергается специальной обработке, в результате которой происходит лизис клеточного материала, удаление белковых и полисахаридных фракций, и получение раствора ДНК или РНК, свободной от ингибиторов и готовой для следующего этапа (амплификации). Выбор методики выделения ДНК (РНК) определяется, прежде всего, характером обрабатываемого клинического материала. Накопление объекта исследования (амплификация) Процесс амплификации проводится в специальном программируемом термостате – амплификаторе, который по заданной программе автоматически осуществляет смену температур согласно числу циклов амплификации. Каждый цикл амплификации при полимеразной цепной реакции протекает в присутствии следующих основных компонентов: · ДНК-матрица (ДНК или ее часть, содержащая искомый специфический фрагмент ДНК в образце любого происхождения); · два синтетических олигонуклеотидных праймера, ограничивающих искомую мишеневую последовательность ДНК. Праймеры – синтетические олигонуклеотидные цепочки (20-30 нуклеотидов) со строго заданной последовательностью нуклеотидов, комплементарные определенным участкам на мишеневой ДНК. · четыре дезоксирибонуклеотида – аденозин, цитидин, гуанозин, тимидин, которые являются материалом для синтеза новых комплементарных цепей ДНК; · термостабильная ДНК-полимераза (Taq-полимераза), выдерживающая нагревание до 95°С, катализирующая удлинение цепей праймеров путем последовательного присоединения нуклеотидных оснований из смеси дезоксирибонуклеотидов к растущей цепи синтезируемой ДНК; · реакционная среда с обязательным присутствием ионов магния, необходимых для поддержания активности ДНК-зависимой ДНК-полимеразы. Исследователь должен заранее определиться какой участок ДНК из известной нуклеотидной последовательности определенного фрагмента ДНК-матрицы будет являться мишеневым (то есть подлежать копированию). В качестве мишеневой ДНК обычно выбирают высококонсервативные области генома, являющиеся специфичными, уникальными, например, для данного вида возбудителя. Следует помнить, что правильный выбор маркерного участка ДНК предопределяет специфичность реакции. Этот этап имеет важнейшее значение, так как может существенно повлиять на результат исследований и таит в себе наибольшее количество ошибок. В основе данного этапа ПЦР лежат особенности синтеза ДНК. Известно, что комплементарное достраивание цепи ДНК начинается не в любой точке последовательности ДНК, а только в определенных стартовых блоках – коротких двунитевых участках. В случае присоединения таких блоков к специфическим участкам ДНК можно направить процесс синтеза новой цепи только в этом участке, а не по всей длине цепи ДНК. Для создания стартовых блоков в заданных участках ДНК используют две олигонуклеотидные «затравки» (их называют праймеры), содержащие 20-30 нуклеотидов, которые комплементарны последовательностям ДНК на правой и левой границах специфического фрагмента и ориентированы таким образом, что достраивание новой цепи ДНК происходит только между ними. Для получения достаточного количества копий искомого специфического фрагмента амплификация ДНК должна включать несколько (20–40) циклов, каждый из которых состоит из 3-х основных этапов (рисунок 4.18).
Рисунок 4.18 - Основные этапы процесса амплификации
1. Денатурация ДНК – плавление ДНК (при 93-950С в течение 30 – 40 с) и разъединение цепей, в результате чего цепочки ДНК становятся доступными для праймеров. 2. Присоединение праймеров (отжиг), происходит комплементарно к соответствующим последовательностям противоположных однонитевых цепей ДНК на границах cпецифического участка. Присоединенные праймеры ориентированы в направлении 5' -3', при этом 3' концы обращены друг к другу. Для каждой пары праймеров существует своя температура отжига в интервале 50 – 65 0С. Продолжительность отжига 20-60 с. 3. Элонгация – комплементарное достраивание ДНК, происходит от 5'-конца к 3'-концу цепи в противоположных направлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей являются присутствующие в реакционной среде дезоксирибонуклеотиды. Процесс синтеза происходит при температуре 70-720С, продолжительность этапа – 20-40 с. Цель первого цикла амплификации – получение двух копий заданного гена. После первого цикла амплификации синтез первых двух копий мДНК заканчивается произвольно (праймерами не ограничен), поэтому на обоих их 3' концах образуются «лохмотья», то есть участки нити ДНК различной длины. Со второго цикла амплификации начинают синтезироваться ампликоны. Ампликоны – короткие, ограниченные по длине с 3' и 5' концов праймерами, продукты амплификации мишеневой ДНК. Циклы амплификации повторяются многократно (30-50 раз), в результате каждого последующего цикла количество ампликонов удваивается и становится достаточным для детекции. Детекция продуктов амплификации в традиционной ПЦР осуществляется следующими основными методами: · электрофоретическое разделение ампликонов с последующей их визуализацией окрашиванием, например, бромидом этидия; · гибридизационные методы детекции в планшетном формате с использованием иммуноферментной реакции с флюорогенными субстратами или прямого измерения флюоресценции олигонуклеотидного зонда после его гибридизации с продуктами реакции в жидкой фазе, либо на специальной подложке; · высокоэффективная жидкостная хроматография. Среди перечисленных методов детекции наиболее широко используется электрофорез ПЦР-амплификационной смеси на агарозном или полиакриламидном гелях. Специфичность полученного ампликона подтверждается его положением (размерами) по отношению к маркерным фрагментам или ДНК-стандарту, обязательно входящему в состав диагностической ПЦР тест-системы. Этап электрофореза увеличивает время и трудоемкость анализа, а значит, и стоимость. Поэтому в последние годы разработаны методы, позволяющие производить оценку результатов без процедуры электрофореза или с использованием скоростных и механизированных вариантов. Специфичность ПЦР в разных лабораториях – 97-98%. Ложноположительные результаты обычно являются следствием контаминации (попадание из внешней среды в реакционную смесь специфических молекул ДНК). Перекрестная контаминация от пробы к пробе может наблюдаться в процессе обработки биоматериала или при раскапывании реакционной смеси. Она приводит к появлению спорадических ложноположительных результатов (случайные ошибки). С другой стороны, возможна контаминация продуктами амплификации (ампликонами), имеющая наибольшее значение, так как ампликоны в процессе реакции накапливаются в огромных количествах и могут загрязнять посуду, автоматические пипетки, лабораторные столы или даже поверхность кожи сотрудников через аэрозоли и загрязнение приборов. Такая контаминация приводит к появлению систематических ложноположительных результатов. Отсюда необходимость жестких требований к условиям организации ПЦР-лабораторий и проведению ПЦР-анализа (см. выше).
|
||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 3479; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.014 с.) |