Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы фракционирования биологических жидкостейСодержание книги
Поиск на нашем сайте
4.3.1. Хроматография Хроматография (от греч. chroma, родительный падеж chromatos - цвет, краска) – один из наиболее избирательных методов разделения близких по химической структуре веществ. Основан на распределении компонентов биологической пробы между неподвижной и подвижной фазами, перемещающимися друг относительно друга. В зависимости от строения разделяемые компоненты в различной степени удерживаются той и другой фазами, в результате чего могут быть отделены друг от друга. Процесс разделения складывается из многократных (повторяющихся сотни раз) актов перехода веществ из одной фазы в другую. Вещество, более родственное с неподвижной фазой, продвигается медленнее через систему, чем вещество более родственное с подвижной фазой. Взаимодействие растворенных веществ с подвижной и неподвижной фазами регулируется физико-химическими процессами: поверхностной адсорбцией, разделением жидкостей, ионным обменом, молекулярным сродством и т. д. На основании этого выделяют различные виды хроматографии (см. ниже). Метод разработан в 1903 российским ученым М.С. Цветом, который показал, что при пропускании смеси растительных пигментов через слой бесцветного сорбента индивидуальные вещества располагаются в виде отдельных окрашенных зон. Полученный таким образом послойно окрашенный столбик сорбента М. Цвет назвал хроматограммой, а метод – хроматографией. Впоследствии термин «хроматограмма» стали относить к разным способам фиксации результатов многих видов хроматографии. Хроматография позволяет разделять вещества очень близкого строения: природные соединения, белки, нуклеиновые кислоты, и даже некоторые биологические объекты, что делает этот метод широко применимым. Особенно это касается белков и нуклеиновых кислот – их разделение хроматографическим методом очень точно позволяет выделять и анализировать вещества близкие по химическому строению (например, Т3 и Т4). В современных модификациях (например, высокоэффективная жидкостная хроматография – ВЭЖХ) возможен анализ, идентификация и разделение очень малых количеств веществ (около 0,000001г) за очень короткое время – 15-20 минут. Принципы разделения и основные термины хроматографии Основа разделения. Молекулы с разным составом или строением осаждаются (сорбируются) на твёрдой поверхности по-разному. Одни – прикрепляются немного прочнее, другие – несколько слабее. Одни – дольше находятся в связанном состоянии и меньше в растворе; другие – чуть дольше задерживаются в растворе и быстрее увлекаются потоком растворителя. Поэтому смесь различных веществ постепенно разделяется на составные части. Каждая такая часть сосредоточивается в своём слое и соответствует какому-то одному химическому соединению. Основные понятия хроматографии Сорбент – вещество-поглотитель = неподвижная фаза. Элюент– раствор = подвижная фаза. При хроматографическом разделении компоненты смеси многократно распределяются между двумя несмешивающимися фазами – подвижной и неподвижной. Захваченные поверхностью твердого тела – сорбента молекулы могут переходить обратно в раствор – элюент, снова поглощаться и вновь растворяться, бесчисленное множество раз меняя своё состояние. Хроматографические системы разделяются по следующим критериям: · агрегатное состояние подвижной и неподвижной фаз; · геометрические характеристики системы; · способ относительного перемещения фаз. 1. Агрегатное состояние фаз. В качестве подвижной фазы используется газ или жидкость. В качестве неподвижной, или стационарной фазы применяются твёрдые вещества или жидкости (таблица 4.2). Таблица 4.2 – Виды хроматографии в зависимости от агрегатного состояния применяемых фаз
2. Механизм взаимодействия между разделяемым веществом и фазами Взаимодействие между разделяемым веществом и фазами хроматографической системы может осуществляться или на поверхности фазы или в объеме. В первом случае хроматография называется адсорбционной, во втором – распределительной. Распределительная хроматография может быть основана на различиях в растворимости вещества, биоспецифических взаимодействиях (например, аффинная хроматография), различном проникновении молекул веществ в поры геля (гель-хроматография). 3. Геометрические характеристики системы По расположению фаз (геометрические характеристики) хроматографические системы подразделяют на две группы: плоскостные и колоночные. В колоночной сорбентом заполняют специальные трубки – колонки. Подвижная фаза движется внутри колонки, благодаря перепаду давления. Разновидность колоночной хроматографии – капиллярная, когда тонкий слой сорбента наносится на внутренние стенки капиллярной трубки. Плоскостная хроматография подразделяется на тонкослойную и бумажную. В тонкослойной хроматографии тонкий слой гранулированного сорбента наносится на стеклянные или металлические пластинки. В случае бумажной ХГ используют специальную хроматографическую бумагу. В плоскостной ХГ перемещение подвижной фазы происходит благодаря капиллярным силам. 4. Способ относительного перемещения фаз В зависимости от способа перемещения разделяемой смеси вдоль слоя сорбента различают следующие варианты хроматографии: проявительный (элюентный), фронтальный и вытеснительный (рисунок 4.12).
Рис. 4.12 – Варианты хроматографического анализа (пояснения в тексте) Сущность проявительного метода (левая часть рисунка 4.12) заключается в следующем. Заполненную сорбентом колонку промывают жидкой или газообразной фазой. Затем, не прекращая потока подвижной фазы, в верхнюю часть колонки вводят анализируемую пробу, состоящую из компонентов А, В, С. Попав на слой сорбента, эти вещества взаимодействуют с подвижной фазой и начинают перемещаться вдоль слоя сорбента по направлению движения подвижной фазы. Если эти вещества обладают разным сродством к неподвижной фазе, то скорость их перемещения разная: в нашем случае компонент А сорбируется слабее, значит продвигается быстрее, за ним движется компонент В, следом – С. В итоге зоны с компонентами будут постепенно образовывать отдельные участки, разделенные чистым элюентом. Таким образом, в данном случае компоненты пробы мигрируют независимо друг от друга, разделение происходит за счет разных скоростей их перемещения. Достоинством данного способа является возможность практически полного разделения смеси на отдельные компоненты (левый график на рис.4.12), недостатком – значительное разбавление компонентов растворителем, что снижает их концентрации на выходе из колонки. При колоночной хроматографии данный вариант используется наиболее широко, постепенно вытесняя все остальные. Фронтальный вариант (рисунок 4.12, центр) является наиболее простым. Анализируемую биопробу, которая одновременно служит подвижной фазой, непрерывно пропускают через слой сорбента. Предположим, исследуемая биопроба содержит 3 исследуемых компонента – А, В и С, различающихся по сродству к сорбенту (А<В<С). Поступающие в верхний слой колонки компоненты биопробы постепенно вытесняют из колонки растворитель. Передний край называют фронтом, откуда и происходит название. В первой зоне находится только наименее удерживаемое вещество А, которое движется быстрее всего. Вторая зона содержит вещество А и В. Третья зона включает смесь веществ – А, В, С. Метод позволяет выделить из смеси только одно, наиболее слабо сорбирующееся вещество (в нашем примере А). Кроме того, недостатком метода является необходимость значительного объема анализируемой пробы. Вытеснительный вариант хроматографии (правая часть рис. 4.12) основан на том, что десорбцию компонентов пробы осуществляют потоком раствора, содержащего специальное вещество – вытеснитель, которое сорбируется лучше любого из разделяемых компонентов. Колонку промывают подвижной фазой, затем вводят биопробу (компоненты А, В, С) и пропускают поток подвижной фазы, содержащей вытеснитель. В результате подвижная фаза вытесняет и проталкивает все компоненты. Сначала она вытесняет наиболее сильно сорбирующийся компонент С, который в свою очередь вытесняет компонент В, а тот вытесняет наименее сорбирующийся компонент А. Таким образом компоненты биопробы перемещаются вдоль колонки в порядке увеличения их сорбционных свойств. На хроматограмме получается ступенчатая кривая (правый график на рис. 4.12), но каждая ступенька соответствует только одному компоненту. В результате каждый компонент не отделяется зоной чистого растворителя (как при проявительном варианте), так как зоны частично перекрываются. Это является существенным недостатком описанного метода. Преимуществом данного варианта является экономность расходования реагентов и биоматериала, так как биопроба не разбавляется растворителем, и емкость сорбента используется очень эффективно. Для проведения хроматографии используют приборы, которые называют «хроматографы». Хроматографический анализ может быть качественным и количественным. Для качественного хроматографического анализа определяют время от момента ввода пробы до выхода каждого компонента из колонки при данной температуре и при использовании определённого элюента. Это время соотносят с известным временем выведения стандартных растворов изучаемых веществ различной концентрации. Для количественного анализа определяют высоты или площади хроматографических пиков с учётом коэффициентов чувствительности используемого детектирующего устройства к анализируемым веществам. При этом важна форма зон (пиков) на хроматограмме. В идеале требуется, чтобы они были как можно более узкими и высокими и более удалены друг от друга, в этом случае легче будет провести анализ и он будет более точным. Сорбенты хроматографического анализа Сорбент является важнейшей частью хроматографической системы, именно от его характеристик и типа зависит возможность разделения веществ. Основные параметры сорбента, имеющие значение для разделения веществ: 1. Размеры частиц. В классической колоночной хроматографии используются сорбенты с размерами частиц 30-200 мкм при высоте колонке 1 м. Однако главный недостаток крупнозернистых сорбентов – большая длина диффузии внутри зерен. В этом случае приходится применять небольшие скорости движения потока. В настоящее время все шире используют так называемые объемно-пористые сорбенты, в которых диаметр частиц равен 3–10 мкм. Преимуществом объемно-пористых сорбентов является большая емкость, что позволяет их использовать не только в аналитических целях, но и для препаративного разделения веществ. 2. Свойства материала сорбентов. Используют самые разные вещества природного происхождения и синтетические – органические и неорганические полимеры. Прежде всего, это сорбенты на основе целлюлозы, агарозы, окиси алюминия, силикагели. 3. Возможность химической модификации. При введении в состав сорбента каких-либо функциональных групп можно получить сорбент с требуемыми свойствами, сродством к определенным классам соединений. 4. Механическая прочность, химическая стойкость. Одним из самых распространенных сорбентов является силикагель, или его многочисленные модификации. Это определяется тем, что силикагель можно легко модифицировать, получать определенный размер частиц, размер пор, определенную удельную поверхность и т.д. К тому же сорбенты на основе силикагеля механически прочны и химически стойки.
Основные виды хроматографии Адсорбционная хроматография. В этом случае разделение веществ осуществляется за счёт выборочной (селективной) адсорбции веществ на неподвижной фазе. Такая селективная адсорбция обусловлена сродством того или иного соединения к твёрдому адсорбенту (неподвижной фазе), а оно, в свою очередь, определяется полярными взаимодействиями их молекул. Поэтому часто хроматографию такого типа используют при анализе соединений, свойства которых определяются числом и типом полярных групп. Ионообменная хроматография. В качестве неподвижной фазы используют ионообменные смолы как в колонках, так и в виде тонкого слоя на пластинке или бумаге. Метод основан на способности некоторых твёрдых веществ – ионообменников обменивать ионы при контакте с растворами электролитов. В качестве ионообменников (ионитов) используют нерастворимые высокомолекулярные вещества природного или синтетического происхождения. Ионообменники бывают двух типов: анионоообменники – аниониты и катионоообменники – катиониты. Особенностью метода является то, что сорбент (ионообменник) способен ионизироваться, отдавая подвижные ионы (H, Na) в подвижную фазу, при этом сам ионообменник приобретает заряд. Гель-фильтрация (гель-хроматография) основана на различной способности молекул разного размера проникать в поры нейтрального геля, который служит неподвижной фазой. В качестве сорбентов в гель-фильтрации наиболее широко используются сефадексы с различными размерами пор, полиакриловые гелии гели агарозы. Они представляют собой мелкие частицы, внутри пронизанные нитями (фибриллами). Диффузия компонентов разделяемого вещества внутрь этих частиц лимитируется размерами, а точнее подвижностью молекул, которая зависит от их молекулярной массы. Чем меньше молекулы, тем легче они способны проникать вовнутрь гранул геля. Соответственно более тяжелые частицы практически не проникают в гранулы. Частицы, попавшие внутрь гранул, надолго там задерживаются, так как пространство внутри гранул геля пронизано нитями, и молекулы претерпевают многочисленные столкновения с сетью фибрилл. Таким образом, скорость продвижения через колонку легких молекул будет меньше скорости движения более тяжелых молекул. Метод очень эффективен для разделения белков и других высокомолекулярных соединений. Аффинная хроматография представляет собой метод разделения веществ, основанный на их специфическом взаимодействии с сорбентом. Сорбентом в данном виде хроматографии служит гель типа агарозы, к которому ковалентно привязаны подходящие лиганды (например, субстрат какого-либо фермента). Когда через такой сорбент пропускают подвижную фазу, то из нее будет сорбироваться только соответствующий фермент. При модификации сорбента соответствующими антителами можно удерживать заданные вирусы, при модификации антигеном удерживать антитела. Метод аффинной хроматографии высоко эффективен из-за селективности специфических взаимодействий. Используется для выделения антигенов, вирусов, белков, лектинов и т.д. Колоночная жидкостная хроматография низкого давления позволяет разделять разнообразные вещества – от низкомолекулярных соединений до сложных биополимеров и их комплексов при нормальном или несколько повышенном давлении. При нормальном давлении производят разделение на мягких сорбентах (сефадексы, гели агарозы, полистирольные гели). Первостепенное значение для эффективности разделения имеет конструкция колонки (длина, толщина, материал). Их обычно изготавливают из инертных материалов (стекло, тефлон, нержавеющая сталь). Скорость элюирования устанавливают в зависимости от типа сорбента и свойств разделяемых веществ. В адсорбционной и ионообменной хроматографии удовлетворительное разделение получают при высокой скорости элюирования, а при гель-хроматографии скорость элюирования должна быть низкой (≈ 10 см/час). Колоночная жидкостная хроматография может применяться для препаративного разделения неорганических (ионообменная хроматография), органических (адсорбционная и распределительная хроматография) веществ и биополимеров (ионообменная, аффинная, гель-хроматография). Высокоэффективная жидкостная хроматография (ВЭЖХ) представляет собой метод разделения веществ на мелкозернистых сорбентах (с размерами частиц 3–15 мкм) при повышенном давлении. Метод характеризуется высокой эффективностью разделения в сочетании с высокой скоростью процесса. Разделяющая способность колонок при ВЭЖХ существенно выше жидкостной хроматографии низкого давления в результате небольших размеров частиц сорбента и их однородности. Продолжительность процесса сокращается за счет использования коротких колонок, это же уменьшает расход реагентов. ВЭЖХиспользуется для анализа, разделения и очистки синтетических полимеров, лекарственных препаратов, детергентов, белков, гормонов и других биологически важных соединений. Использование высокочувствительных детекторов позволяет работать с очень малыми количествами веществ (10-11-10-9г), что исключительно важно в биологических исследованиях. Метод широко применяется в токсикологических лабораториях. Тонкослойная хроматография основана на различии скоростей перемещения компонентов анализируемой пробы в плоском тонком слое сорбента при движении по нему растворителя (элюента) под действием капиллярных или гравитационных сил. Неподвижной фазой служит либо сухой сорбент (адсорбционная хроматография), либо сорбент, покрытый жидкой фазой, например, слоем воды (распределительная хроматография). Разделенные компоненты в виде пятен на пластинке можно идентифицировать различными аналитическими методами: ультрафиолетовой спектрофотометрией, специальными способами окрашивания и т. д. Метод имеет ряд преимуществ, прежде всего, простота и легкость исследования, высокая скорость, экономичность, отсутствие необходимости предварительной подготовки биопробы, возможность анализа нестойких веществ, причем, одновременно в нескольких образцах. Различные варианты тонкослойной хроматографии приобретают в настоящее время широкое распространение в клинико-диагностических лабораториях для анализа жиров, углеводов, белков, а также неорганических соединений.
Электрофорез Электрофорез – процесс разделения заряженных частиц под действием внешнего электрического поля. В результате проведения электрофореза можно осуществлять идентификацию и определение количества различных макромолекул, микрочастиц, клеток по их подвижности в направлении силовых линий электрического поля. Электрофорез применяют для исследования веществ, молекулы которых в соответствующих условиях заряжены и различаются по электрофоретической подвижности. Конкретные условия для разделения подбирают путем изменения характеристик внешней среды (рН среды, температуры, состава и концентрации буферного раствора или носителя). На примере разделения белков принцип метода можно представить следующим образом. Белки являются амфотерными веществами, которые в кислой среде присоединяют протон и ведут себя как катионы, а в щелочной среде – отдают протон и приобретают свойство анионов. В изоэлектрической точке они становятся ионами с нулевым суммарным зарядом, то есть нейтральными молекулами, в которых противоположные заряды пространственно разделены. Суммарный заряд молекул зависит от рН буфера, в котором растворен белок. Изменяя этот параметр, можно менять направление и скорость миграции белков в электрическом поле, то есть разделять белки в анализируемой биопробе. Эффективность разделения зависит не только от суммарного заряда молекул, но и от их размеров. При этом крупные молекулы с высоким суммарным зарядом могут мигрировать на то же расстояние, что и небольшие молекулы с низким суммарным зарядом. Определяющим параметром при этом является соотношение заряд/масса, которое и определяет электрофоретическую подвижность молекул исследуемого компонента. Электрофорез можно осуществлять в растворе или использовать специальные носители из пористого материала, не проводящие ток. Среда-носитель служит для поддержания стабильности различий в плотности раствора разделяемого вещества и буфера, а также электрофоретических зон, которые легко разрушаются от нагрева, возникающего при прохождении электрического тока через буферный раствор. Однако следует иметь в виду, носитель может оказывать влияние на условия электрофореза и тем самым изменять эффективность разделения (за счет размера пор, адсорбции, собственных химических свойств и т.д.). По эффективности разделения можно выделить две группы материалов-носителей: 1. Ацетацеллюлоза, агар, агароза. Это относительно инертные материалы с порами больших размеров, которые слабо влияют на эффективность разделения. 2. Крахмальные и акриламидные гели. Эти носители содержат поры, сравнимые по размерам с размерами белковых молекул. Поэтому на них возможно разделение веществ с одинаковыми суммарными зарядами, но различными молекулярными массами. Электрофореграммы, полученные на таких носителях, содержат больше фракций, чем на ацетатцеллюлозе, агаре и агарозе. Так, электрофорез на полиакриламидном геле позволяет выделить 20 и более фракций белков из сыворотки. Из перечисленных выше носителей наибольшее распространение в клинико-диагностических лабораториях получил ацетат целлюлозы. Электрофорез на ацетатцеллюлозе имеет ряд преимуществ – малое количество образца (0,3 – 2 мкл сыворотки), время разделения 20-60 минут. Количество получаемых фракций меньше, чем при использовании носителей второго типа (при электрофорезе сыворотки – 5 фракций, включая преальбумин), однако именно они являются наиболее клинически информативными. Электрофорез осуществляется с помощью специальных приборов для электрофореза. Процедура состоит в том, что носитель помещается в электрофоретическую камеру, содержащую буферный раствор. Буферный раствор выполняет двоякую роль: проводит электрический ток и поддерживает определенную рН, определяя электрический заряд растворенного вещества. Избыток буферного раствора удаляют. Исследуемый биоматериал (например, сыворотка крови) наносится на носитель, устанавливается требуемая сила тока. По окончании электрофореза смесь макромолекул оказывается разделенной на дискретные зоны, каждая из которых состоит из частиц с близкими значениями электрофоретической подвижности. Носитель вынимают из камеры, высушивают (или закрепляют для предупреждения диффузии компонентов пробы), а затем окрашивают специфичным для данного класса веществ красителем. Для окрашивания электрофореграмм белков используют амидочерный, бромфеноловый голубой и другие красители. Окрашивание позволяет визуализировать отдельные зоны на электрофореграмме. По положению зон относительно места старта осуществляется идентификация отдельных фракций разделенного вещества (рисунок 4.13).
Рисунок 4.13 – Электрофореграмма белков сыворотки крови на ацетатцеллюлозной пленке На нижнем рисунке – результат количественного определения основных белковых фракций крови методом денситометрии (денситограмма).
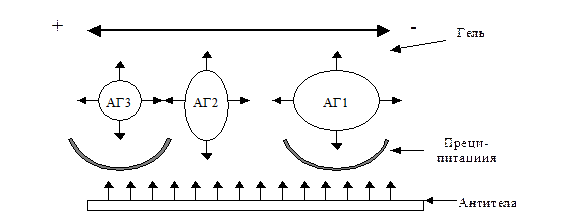
Количественная оценка содержания разделенных компонентов осуществляется по интенсивности окрашивания разделенных зон с помощью специального фотометрического прибора – денситометра, работающего в отраженном от препарата потоке излучения оптического диапазона. Результаты выражаются в графической форме (в виде пиков) и в цифровой форме (рис) В клинической практике электрофорез широко применяется в исследовании белков и их компонентов, липопротеинов и нуклеиновых кислот. Одним из наиболее современных и перспективных методов электрофореза является изоэлектрическое фокусирование (ИЭФ). Метод используется преимущественно для исследования белков. Сущность ИЭФ заключается в том, что молекулы белков мигрируют под действием электрического поля в среде с линейным и стабильным градиентом рН до достижения области, соответствующей их изоэлектрической точке (значение рН, при котором белок теряет заряд, а, следовательно, и подвижность в электрическом поле). Если в стабилизирующей среде создать градиент рН, то заряженные молекулы белка, двигаясь по электрическому полю, попадают в область носителя с рН, равным их изоэлектрической точке, и теряют подвижность: каждый белок фокусируется на среде со своей изоэлектрической точкой. Таким образом, ИЭФ использует зависимость знака и величины заряда молекулы белка от рН окружающего раствора. Метод обладает очень высокой разрешающей способностью: удается надежно разделить два белка, отличающиеся по ИЭТ всего на 0,02 ед. рН. Иммуноэлектрофорез В данную группу объединены методы, конечный этап разделения которых основан на специфической реакции связывания антигена пробы с антителом добавляемой в носитель сыворотки, что позволяет определить состав исходной смеси антигенов. Существует несколько десятков модификаций иммуноэлектрофореза. Рассмотрим некоторые из них. Классический иммуноэлектрофорез. На первом этапе производят разделение белков в забуференном агаровом или агарозном геле, а затем латерально, параллельно разделенным компонентам прорезают щели, которые заполняют антисывороткой. Выдерживают в течение некоторого времени для диффузии компонентов (обычно ночь). Взаимодействие антиген-антитело обнаруживается по дугам преципитации (рисунок 4.14). Метод позволяет выявить антигенный состав сложной смеси белков и идентифицировать отдельные компоненты смеси с помощью моноспецифических антисывороток. В клинике используется для типирования парапротеинов сыворотки и выявления белков Бенс-Джонса. Недостаток метода – отсутствие возможности количественного анализа.
Рисунок 4.14 – Схема классического варианта иммуноэлектрофореза Процесс включает следующие стадии: 1) электрофоретическое разделение белков (антигенов) в геле; 2) внесение иммунной сыворотки в канавку, сформированную в геле; 3) диффундирование АГ и АТ в геле навстречу друг другу, в результате чего в месте их взаимодействия (при условии соответствия АГ и АТ) возникают дуги преципитации. Процесс иммунодиффузии продолжается около 24 часов во влажной камере; 3) промывка пластины геля для удаления белков, которые не участвовали в преципитации; 4) сушка и окрашивание образцов специальными красителями. Результат оценивают по количеству, положению и форме зон преципитации. Иммуноэлектрофорез методом переноса. Основан на принципе классического иммуноэлектрофореза. Отличие состоит в том, что первичное электрофоретическое разделение производится на ацетатцеллюлозе, затем ацетатцеллюлозу переносят на поверхность чашки с агаром и на расстоянии 3-5 мм параллельно зоне электрофоретического разделения помещают полоски фильтровальной бумаги, смоченные соответствующей антисывороткой. При взаимодействии антигена и специфических антител образуются дуги преципитации. Преимущества метода – возможность более легкой идентификации отдельных белков (описанная методика уменьшает плотность дуг преципитации). Ракетный имуноэлектрофорез (двумерный) происходит по схеме, представленной на рисунке 4.15.
Рисунок 4.15 – Схема проведения ракетного электрофореза Электрофорез происходит в геле агарозы, содержащем специфические антитела. При этом антигены (Ag) движутся по направлению к аноду и взаимодействуют с АТ в геле. Это приводит к образованию длинных ракетоподобных участков преципитации, которые легко увидеть при окрашивании геля. Процесс завершается, конца зона преципитации образует на конце острие. Длина и площадь зоны преципитации пропорциональны концентрации исследуемого антигена. Описанный метод позволяет провести количественное определение концентрации антигена, сравнивая тестовые и контрольные образцы, одновременно подвергшиеся электрофорезу. Общая продолжительность реакции 3-18 часов. Используется специальная электрофоретическая камера с охлаждением. Существует модификация данного метода с применением ацетат-целлюлозных мембран.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 1066; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.50.170 (0.01 с.) |